
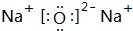 ��
������ X��Y��Z��M��G��Q�����ֶ���������Ԫ�أ�ԭ��������������Z��G�ֱ��ǵؿ��к�����ߵķǽ���Ԫ�غͽ���Ԫ�أ���ZΪOԪ�ء�GΪAlԪ�أ�Y��ԭ������������������Ӳ�����2����ԭ������С��O��ֻ�ܴ��ڵڶ����ڣ�����������Ϊ4����YΪCԪ�أ�X�����ڳ����³���̬����XΪHԪ�أ�X��Mͬ���壬ԭ����������O����MΪNa��Q���ʳ�����Ϊ��̬��ԭ����������Al����QΪCl���ݴ˽��н��
��� �⣺X��Y��Z��M��G��Q�����ֶ���������Ԫ�أ�ԭ��������������Z��G�ֱ��ǵؿ��к�����ߵķǽ���Ԫ�غͽ���Ԫ�أ���ZΪOԪ�ء�GΪAlԪ�أ�Y��ԭ������������������Ӳ�����2����ԭ������С��O��ֻ�ܴ��ڵڶ����ڣ�����������Ϊ4����YΪCԪ�أ�X�����ڳ����³���̬����XΪHԪ�أ�X��Mͬ���壬ԭ����������O����MΪNa��Q���ʳ�����Ϊ��̬��ԭ����������Al����QΪCl��
��1�����ӵĵ��Ӳ�Խ�࣬���Ӱ뾶Խ���Ӳ���ͬʱ�����ӵĺ˵����Խ�����Ӱ뾶ԽС�������Ӱ뾶��СΪ��Cl-��O2-��Na+��Al3+��
�ʴ�Ϊ��Cl-��O2-��Na+��Al3+��
��2������Ԫ�ص�����������Ӧ��ˮ����������ǿ����HClO4��������ǿ��ΪNaOH�����߷�Ӧ�����ӷ���ʽΪ��H++OH-=H2O��
�ʴ�Ϊ��H++OH-=H2O��
��3��H��C���γɶ��ֻ�������мȺ����Լ��ֺ��Ǽ��Լ�������Է���������С��������C2H2������Ϊ��Ȳ����ʵ�����У���ȡ�����ʵķ�Ӧԭ���ǣ�CaC2+2H2O��Ca��OH��2+C2H2����
�ʴ�Ϊ����Ȳ��CaC2+2H2O��Ca��OH��2+C2H2����
��4��Na2OΪ���ӻ�����ĵ���ʽΪ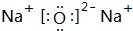 ��
��
�ʴ�Ϊ��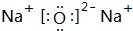 ��
��
��5�������£�Al������ͭ��Һ��Ӧ�û�ͭ����Ũ���ᷴӦ�������ܵ������ﱣ��Ĥ�������ۻ�����������������Һ��Ӧ����ƫ����������������������������̼���Ʒ�Ӧ��
��ҵ���õ�ⷨ��Al�ĵ��ʵĻ�ѧ����ʽ��2Al2O3�����ڣ�$\frac{\underline{\;\;\;ˮ��\;\;\;}}{����ʯ}$4Al+3O2��������ʯīΪ�缫������������������̼��Ӧ���ɶ�����̼��CO���������Ļ������ijɷ���O2��CO2�ȣ�
�ʴ�Ϊ��be��2Al2O3�����ڣ�$\frac{\underline{\;\;\;ˮ��\;\;\;}}{����ʯ}$4Al+3O2����O2��CO2�ȣ�
���� ���⿼��ṹ����λ�ù�ϵӦ�ã���Ŀ�Ѷ��еȣ��ƶ�Ԫ���ǽ���ؼ������ضԻ�ѧ����Ŀ��飬��5��ע��Al������ʵķ�Ӧ��ѧ�����װѶۻ���������Ϊ����Ӧ��


 ��ս�п�����ϵ�д�
��ս�п�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 27 mg | B�� | 54 mg | C�� | 108 mg | D�� | 216 mg |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

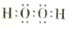 �����ܽ⡱��ͭԪ�ص���Ҫ������ʽ��Cu2+�������ӷ��ţ���
�����ܽ⡱��ͭԪ�ص���Ҫ������ʽ��Cu2+�������ӷ��ţ����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 ��֪����ʱ0.1mol/L��CH3COOH��ҺpHԼΪ2.5����20mL 0.1mol/L CH3COOH��Һ��20mL 0.1mol/L��HSCN��Һ�ֱ��ڵ������Ũ�ȵ�NaHCO3��Һ��Ӧ��ʵ���ò���CO2���������V����ʱ��t�Ĺ�ϵ��ͼ������˵������ȷ���ǣ�������
��֪����ʱ0.1mol/L��CH3COOH��ҺpHԼΪ2.5����20mL 0.1mol/L CH3COOH��Һ��20mL 0.1mol/L��HSCN��Һ�ֱ��ڵ������Ũ�ȵ�NaHCO3��Һ��Ӧ��ʵ���ò���CO2���������V����ʱ��t�Ĺ�ϵ��ͼ������˵������ȷ���ǣ�������| A�� | ����ʱCH3COOH�ĵ���ƽ�ⳣ��ԼΪ10-4 | |
| B�� | ������ӵ�������SCN-��CH3COO-��HCO3- | |
| C�� | ��Ӧ��������Һ��c��CH3COO-����c��SCN-�� | |
| D�� | �������pH��CH3COOH��HSCN�ֱ���20mL 0.1mol/L��NaHCO3��Һ��Ӧ����ʼʱ���߲���CO2��������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
 ��
��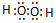 ��д���ɸ������Ʊ�D��һ�ֳ������ʵķ�Ӧ�Ļ�ѧ����ʽ2H2O2$\frac{\underline{\;����\;}}{\;}$2H2O+O2��
��д���ɸ������Ʊ�D��һ�ֳ������ʵķ�Ӧ�Ļ�ѧ����ʽ2H2O2$\frac{\underline{\;����\;}}{\;}$2H2O+O2���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

| ������ | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
| ��ʼ����ʱ�� pH | 1.9 | 7.0 | 9.3 | 3.7 | 4.7 | �� |
| ������ȫʱ�� pH | 3.2 | 9.0 | 11.1 | 5.2 | 6.7 | 9����9�ܽ⣩ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
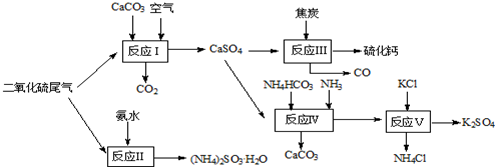
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com