
 工业上以硫为原料生产硫酸,已知4g硫完全可放出aKJ的热,则
工业上以硫为原料生产硫酸,已知4g硫完全可放出aKJ的热,则分析 (1)根据n=$\frac{m}{M}$计算出4gS单质的物质的量,然后可计算出1molS单质燃烧放出的热量,再根据热化学方程式的书写原则解答;
(2)根据△H-T△S<0反应自发进行分析;
(3)该反应是一个反应前后气体体积减小的放热反应,欲提高SO2的转化率,则改变条件使平衡向正反应方向移动;
(4)A.根据体积之比等于物质的量之比计算平衡时混合气体总的物质的量,再利用差量法计算参加反应的二氧化硫的物质的量,结合热化学方程式计算放出的热量;
B.该反应前后气体体积不相等,则物质的量不变时得到平衡状态;
C.恒温恒压,两次达到平衡状态相同分析计算判断;
D.恒温恒压,两次达到平衡状态相同分析判断
E.根据A计算可知,原平衡时SO3的体积分数为$\frac{1mol}{4.5mol}$=$\frac{2}{9}$;
(5)依据化学平衡三段式计算平衡浓度,结合平衡常数概念计算;
(6)压强的增加引起SO2转化率的变化并不明显,所以工业上直接采用常压,平衡常数随温度变化.
解答 解:(1)4gS的物质的量为:$\frac{4g}{32g/mol}$=$\frac{1}{8}$mol,则1molS单质完全燃烧放出的热量为:akJ×$\frac{1mol}{\frac{1}{8}}$=8akJ,则硫单质燃烧的热化学方程式为:S(s)+O2(g)=SO2(g)△H=-8akJ/mol,
故答案为:S(s)+O2(g)=SO2(g)△H=-8akJ/mol;
(2)反应2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ•mol-1为放热反应,△H<0,该反应为气体体积缩小的反应,则△S<0,若反应能够自发进行,应该满足△H-T△S<0,则该反应需要在低温下自发进行,
故答案为:低温;
(3)A.向装置中充入过量的O2,化学平衡正向移动,会提高二氧化硫转化率,故A正确;
B.升高温度,化学平衡逆向移动,二氧化硫的转化率减小,故B错误;
C.向装置中充入N2,化学平衡不会移动,不会提高二氧化硫转化率,故C错误;
D.向装置中充入过量的SO2,二氧化硫转化率降低,故D错误;
故答案为:A;
(2)A.由题意气体体积为起使时的90%,则反应后总的物质的量为起始时的90%,平衡时总物质的量为(3mol+2mol)×90%=4.5mol,则平衡时各组成物质的量变化为:
2SO2+O2?2SO3 物质的量减少△n
2 1 2 1
1mol 0.5mol 1mol (3mol+2mol)-4.5mol=0.5mol
此时放出的热量为196.6kJ×$\frac{0.5mol}{1mol}$=98.3kJ,故A错误;
B.该反应为气体体积变化的反应,当气体物质的量不发生变化时说明该反应达到平衡状态,故B正确;
C.2SO2 +O2 ?2SO3
起始量(mol) 3 2 0
变化量(mol) x 0.5x x
平衡量(mol)3-x 2-0.5x x
反应后总的物质的量为起始时的90%,3-x+2-0.5x+x=4.5,x=1mol,二氧化硫转化率=$\frac{1mol}{3mol}$×100%=$\frac{1}{3}$;
保持同一反应温度,在相同容器中,将起始物质的量改为 5mol SO2(g)、3.5mol O2(g)、1mol SO3(g),转化为起始量为6molSO2(g)、4molO2,恒压条件下两次平衡时等效平衡,平衡后二氧化硫应为4mol,转化率=$\frac{1mol}{5mol}$×100%=20%,故C错误;
D.依据B分析可知等效平衡状态,氧气体积分数相同,故D正确;
E.原平衡时SO3的体积分数为$\frac{1mol}{4.5mol}$=$\frac{2}{9}$,两个平衡为等效平衡,则第二次平衡时SO3的体积分数为$\frac{2}{9}$,故E正确;
故答案为:BDE;
(5)500℃时将10mol SO2和5.0mol O2置于体积为1L的恒容密闭容器中,SO2转化为SO3的平衡转化率为0.8,反应的二氧化硫物质的量=9.5mol;
2SO2 +O2 ?2SO3
起始量(mol/L) 10 5 0
变化量(mol/L) 8 4 8
平衡量(mol/L) 2 1 8
则500℃时的平衡常数为:K=$\frac{{8}^{2}}{{2}^{2}×1}$=16
故答案为:16;
(6)从图象中可以看出,常压SO2就可以达到较高的转化率,压强的增加引起SO2转化率的变化并不明显,加压必须增大投资以解决增加设备和提供能量问题,所以工业上直接采用常压;平衡常数随温度变化,不随压强变化,平衡常数不变,即K(0.10MPa)=K(1.0MPa),
故答案为:常压下550°C,SO2转化率已经较高;=.
点评 本题考查了化学平衡的计算,题目难度中等,涉及化学平衡常数的计算、热化学方程式书写、化学平衡及其影响等知识,试题知识点较多、综合性较强,充分考查了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. |  | B. |  | ||
| C. |  | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 H2SO32H2SO3+O2
H2SO32H2SO3+O2 2H2SO4.
2H2SO4. 2SO3反应的△H=-198kJ/mol,是放热反应.当压强一定时,温度升高,平衡左移,SO2平衡转化率减小.
2SO3反应的△H=-198kJ/mol,是放热反应.当压强一定时,温度升高,平衡左移,SO2平衡转化率减小.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 温度/℃ | 1000 | 1150 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小.请回答下列问题:
FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 容器内气体压强保持不变 | |
| B. | 吸收ymolH2只需1 mo1MHx | |
| C. | 若向容器内通入少量氢气,则V(放氢)>V(吸氢) | |
| D. | 若降温,该反应的平衡常数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 方法1 | 用氨水将SO2转化为NH4HSO3,再氧化成(NH4)2SO4 |
| 方法2 | 用水煤气(主要成分为CO、H2等)将SO2在高温下还原成单质硫 |
| 方法3 | 用Na2SO3溶液吸收SO2转化为NaHSO3,再经电解转化为H2SO4 |
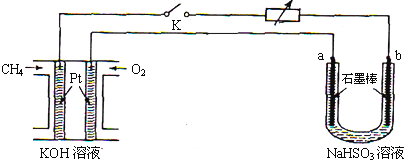
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
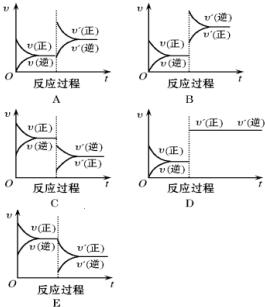
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为了节约应将实验过程中取用的剩余药品放回原试剂瓶 | |
| B. | 在汽油罐上所贴的危险化学品标志内容是:遇湿易燃物品 | |
| C. | 酒精着火,迅速用湿抹布或沙子盖灭 | |
| D. | 氢氧化钠溶液溅入眼中,应立即用大量水冲洗,再用稀盐酸冲洗 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com