
| A、①中水的电离程度最小,③中水的电离程度最大 |
| B、将②、③混合,若pH=7,则消耗溶液的体积:②>③ |
| C、将①、④混合,若c(CH3COO-)>c(H+),则混合液一定呈碱性 |
| D、将四份溶液分别稀释100倍后,溶液的pH:③>④,①<② |


科目:高中化学 来源: 题型:
| A、浓度相同时HA溶液的导电性比强酸弱 |
| B、10mL 1mol/L的HA溶液与10mL 1mol/L的NaOH溶液恰好完全反应 |
| C、NaA溶液的pH>7 |
| D、0.1mol/LHA溶液的pH=1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 |
 |
 |
 |
| A.配制100mL 0.1mol/L盐酸 |
B. 验证AgCl和Ag2S的溶解性 | C.测定中和反应 的反应热 |
D.实验室制取 并收集氨气 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、减少CO2的排放,可以减少酸雨的产生 |
| B、减少SO2的排放,可以从根本上消除雾霾 |
| C、“天宫一号”使用的碳纤维,是一种新型有机高分子材料 |
| D、用CO2合成聚碳酸酯可降解塑料,可以实现“碳”的循环利用 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、装置I,铜片上有O2逸出 |
| B、装置I,锌片溶解,发生还原反应 |
| C、装置Ⅱ,电池反应为:Zn+Cu2+═Zn2++Cu |
| D、装置Ⅱ,外电路中,电子从锌电极流向铜电极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D | |
图示 |
 |
 |
 |
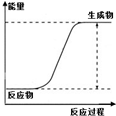 |
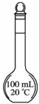
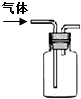
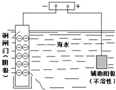
| 说明 | 该仪器用于配制一定质量分数的溶液 | 该装置可以收集二氧化氮 | 该装置可保护钢闸门不被腐蚀 | 该化学反应为吸热反应 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=5的NH4Cl溶液或醋酸中,由水电离出的c(H+)均为10-9mol/L |
| B、pH=3的醋酸和pH=11的NaOH溶液等体积混合后,pH>7 |
| C、同体积同pH的氢氧化钠溶液和氨水分别稀释相同倍数,氨水的pH较大 |
| D、0.1mol/L Na2CO3溶液和0.1mol/L NaHSO4溶液等体积混合,溶液中c(Na+)+c(H+)=c(CO32-)+c(SO42-)+c(HCO3-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 称量氢氧化钠固体 |
B、 配制150mL 0.10mol/L盐酸 |
C、 检验铁粉与水蒸气反应产生的氢气 |
D、 分离两种互溶但沸点相差较大的液体混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 2SO2(g)+O2(g)?2SO3(g) | N2(g)+3H2(g)?2NH3(g) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com