
在一定温度下的恒容密闭容器中,能说明反应X2(g)+ Y2(g) 2XY(g) 已达到平衡的是( )
2XY(g) 已达到平衡的是( )
| A.容器中的总压不随时间变化 |
| B.容器中的气体平均相对分子质量不随时间变化 |
| C.容器中的混合气体的密度不随时间变化 |
| D.容器中的各种气体的质量分数不随时间变化 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:计算题
以下是一些物质的熔沸点数据(常压):
| | 钾 | 钠 | Na2CO3 | 金刚石 | 石墨 |
| 熔点(℃) | 63.65 | 97.8 | 851 | 3550 | 3850 |
| 沸点(℃) | 774 | 882.9 | 1850(分解产生CO2) | ---- | 4250 |
 2 Na2CO3(l)+ C(s,金刚石) △H=-1080.9kJ/mol
2 Na2CO3(l)+ C(s,金刚石) △H=-1080.9kJ/mol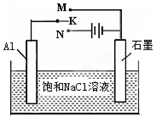
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在恒容密闭容器中,一定条件下进行如下反应:NO(g)+CO(g) 
 N2(g)+CO2(g);△H=-373.2kJ·mol-1 ,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
N2(g)+CO2(g);△H=-373.2kJ·mol-1 ,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
| A.加催化剂同时升高温度 | B.加催化剂同时增大压强 |
| C.温度不变同时充入Ar | D.降低温度同时增大压强 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
一定条件下,可逆反应:X(g) + 3Y(g) 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),反应达到平衡时, X、Y、Z的浓度分别为0.1mol?L-1、0.3 mol?L-1、0.08 mol?L-1,则下列判断不正确的是 ( )
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),反应达到平衡时, X、Y、Z的浓度分别为0.1mol?L-1、0.3 mol?L-1、0.08 mol?L-1,则下列判断不正确的是 ( )
| A.c1∶c2="=" 1∶3 | B.平衡时,Y和Z生成速率之比为3∶2 |
| C.X、Y的转化率不相等 | D.c1的取值范围为0< c1< 0.14 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在容积为VL的密闭容器中放入2LA和1LB,3A(g)+B(g)  nC(g)+2D(g),达到平衡后,A物质的量减少1/2,混合气体的平均摩尔质量增大1/8,则该反应中n的值( )
nC(g)+2D(g),达到平衡后,A物质的量减少1/2,混合气体的平均摩尔质量增大1/8,则该反应中n的值( )
| A. 1 | B. 2 | C. 3 | D. 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
现有可逆反应:X(g)+Y(g) 2Z(g)+W(s)
2Z(g)+W(s)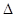 H<0,下图a曲线表示X的转化率随时间的变化关系。若改变起始条件使反应按b曲线进行,可采取的措施是
H<0,下图a曲线表示X的转化率随时间的变化关系。若改变起始条件使反应按b曲线进行,可采取的措施是
| A.降低温度 | B.增大Y的浓度 | C.加入催化剂 | D.增大容器的体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
一定条件下,对于可逆反应X(g)+3Y(g) 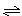 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol/L、0.3 mol/L、0.08 mol/L,则下列判断正确的是
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol/L、0.3 mol/L、0.08 mol/L,则下列判断正确的是
| A.c1∶c2=3∶1 | B.平衡时,Y和Z的生成速率之比为2∶3 |
| C.X、Y的转化率相等 | D.c1的取值范围为0.04 mol/L<c1<0.14 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
定容容器中反应:N2(g)+3H2(g) 2NH3(g),下列措施不能提高其反应速率的是( )。
2NH3(g),下列措施不能提高其反应速率的是( )。
| A.升高温度 | B.使用催化剂 |
| C.充入稀有气体,增大体系压强 | D.增加N2和H2的起始量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com