
【题目】“绿水青山就是金山银山”,因此研究NOx、SO2等大气污染物的妥善处理具有重要意义。
(1)亚硝酰氯(Cl—N=O)气体是有机合成的重要试剂,它可由Cl2和NO在通常条件下反应制得,该反应的热化学方程式为__。
相关化学键的键能如下表所示:
化学键 | Cl—Cl | N | Cl—N | N=O |
键能/(kJ·mol-1) | 243 | 630 | 200 | 607 |
(2)燃煤发电厂常利用反应2CaCO3(s)+2SO2(g)+O2(g)![]() 2CaSO4(s)+2CO2(g) ΔH=-681.8kJ·mol-1,对煤进行脱硫处理来减少SO2的排放。对于该反应,在T℃时,借助传感器测得反应在不同时间点上各物质的浓度如下:
2CaSO4(s)+2CO2(g) ΔH=-681.8kJ·mol-1,对煤进行脱硫处理来减少SO2的排放。对于该反应,在T℃时,借助传感器测得反应在不同时间点上各物质的浓度如下:
时间/min 浓度/mol·L-1 | 0 | 10 | 20 | 30 | 40 | 50 |
O2 | 1.00 | 0.79 | 0.60 | 0.60 | 0.64 | 0.64 |
CO2 | 0 | 0.42 | 0.80 | 0.80 | 0.88 | 0.88 |
①0~10min内,平均反应速率v(CO2)=___mol·L-1·min-1;当升高温度,该反应的平衡常数K__(填“增大”、“减小”或“不变”)。
②30min后,只改变某一条件,反应重新达到平衡。根据上表中的数据判断,改变的条件可能是__(填字母)。
A.加入一定量的粉状碳酸钙
B.适当缩小容器的体积
C.通入一定量的O2
D.加入合适的催化剂
(3)NOx的排放主要来自于汽车尾气,有人利用反应C(s)+2NO(g)![]() N2(g)+CO2(g) ΔH=-34.0kJ·mol-1,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:
N2(g)+CO2(g) ΔH=-34.0kJ·mol-1,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:
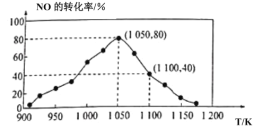
由图可知,1050K前反应中NO的转化率随温度升髙而增大,其原因为__。
②用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在1050K、1.1×106Pa时,该反应的化学平衡常数Kp=__[已知:气体分压(P分)=气体总压(Pa)×体积分数]
(4)为避免汽车尾气中的有害气体对大气的污染,需给汽车安装尾气净化装置。在净化装置中CO和NO发生反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ΔH=-746.8kJ·mol-1,生成无毒的N2和CO2实验测得,v正=k正c2(NO)·c2(CO),v逆=k逆c(N2) c2(CO2)(k正、k逆为速率常数,只与温度有关)。
N2(g)+2CO2(g) ΔH=-746.8kJ·mol-1,生成无毒的N2和CO2实验测得,v正=k正c2(NO)·c2(CO),v逆=k逆c(N2) c2(CO2)(k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅降低温度,k正减小的倍数_(填“>”、“<”或“=”)k逆减小的倍数。
②若在1L的密闭容器中充入1molCO和1molNO,在一定温度下达到平衡时,CO的转化率为20%,则![]() =__(计算结果用分数表示)
=__(计算结果用分数表示)
【答案】2NO(g)+Cl2(g)=2NOCl(g) ΔH=-111kJ/mol 0.042 减小 BC 1050K前反应未达到平衡状态,随着温度升高,反应速率加快,NO转化率增大 4 < ![]()
【解析】
根据ΔH=生成物的总键能-反应物的总键能计算反应热,进而写出热化学反应方程式;根据v=![]() 计算;根据30min后,氧气、二氧化碳的浓度都增大,改变的条件可为加入氧气或适当缩小容器的体积等;根据在1050 kPa时反应达到平衡,在1050 kPa前,温度升高对化学反应速率及反应进行的方向分析判断;根据在1100kPa时NO转化率40%,结合三行计算列式得到。
计算;根据30min后,氧气、二氧化碳的浓度都增大,改变的条件可为加入氧气或适当缩小容器的体积等;根据在1050 kPa时反应达到平衡,在1050 kPa前,温度升高对化学反应速率及反应进行的方向分析判断;根据在1100kPa时NO转化率40%,结合三行计算列式得到。
(1)根据题干信息可知,Cl2和NO在通常条件下反应制得亚硝酰氯(Cl—N=O)气体,反应方程式为2NO(g)+C12(g)![]() 2C1NO(g),反应的△H=反应物的键能之和-生成物的键能之和=(2×630+243)-(2×200+2×607)=-111kJ/mol,故答案为:2NO(g)+Cl2(g)=2NOCl(g) ΔH=-111kJ/mol;
2C1NO(g),反应的△H=反应物的键能之和-生成物的键能之和=(2×630+243)-(2×200+2×607)=-111kJ/mol,故答案为:2NO(g)+Cl2(g)=2NOCl(g) ΔH=-111kJ/mol;
(2)①在0~10min内,Δc(CO2)=0.42mol/L,根据v=![]() ,CO2的化学反应速率v(CO2)=
,CO2的化学反应速率v(CO2)=![]() =0.042mol/(Lmin),正反应为放热反应,升高温度,平衡向左移动,故化学平衡常数K减小,故答案为:0.042;减小;
=0.042mol/(Lmin),正反应为放热反应,升高温度,平衡向左移动,故化学平衡常数K减小,故答案为:0.042;减小;
②30min后,氧气、二氧化碳的浓度都增大,可为加入氧气或适当缩小容器的体积等,故答案为:BC;
(2)①由图像可知,当温度高于1050K时,随着温度升高,NO的转化率降低,则平衡逆向移动,因此该反应的正反应为放热反应,即ΔH<0,1050kPa前,反应b中NO2转化率随着温度升高而增大是由于1050kPa前反应未达平衡状态,随着温度升高,反应速率加快,更多的反应物变为生成物,因此NO2转化率随温度的升高而增大,故答案为:1050K前反应未达到平街状态,温度的升高,反应速率加快,NO转化率增大;
②由图像可知,在1050K、1.1×106Pa时,NO转化率80%,可列平衡三段式为:
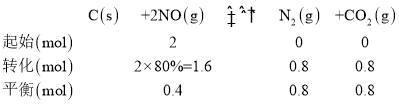
由于容器的容积不变,因此气体的物质的量的比等于气体压强之比,可知平衡时p(NO)=0.2p(总),p(N2)=0.4 p(总),p(CO2)=0.4 p(总),则用平衡分压表示的化学平衡常数
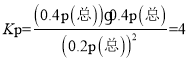 ,故答案为:4;
,故答案为:4;
(4)①正反应为放热反应,升高温度平衡向左移动,则正反应速率增大的倍数小于逆反应速率增大的倍数,浓度不变,故k正增大的倍数小于k逆增大的倍数,故答案为:<;
②若在1L的密闭容器中充入1molCO和1molNO,在一定温度下达到平衡时,CO的转化率为20%,可列平衡三段式为:
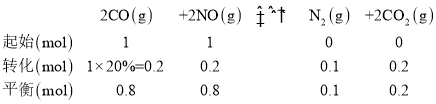
则平衡常数![]() ,当反应达到平衡时,υ正=υ逆,故
,当反应达到平衡时,υ正=υ逆,故![]() ,故答案为:
,故答案为:![]() 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】在0.2 L由NaCl溶液、MgCl2溶液、CuCl2溶液组成的混合溶液中,部分离子的浓度如图所示。
(1)混合液中,NaCl的物质的量为_______mol,MgCl2的质量为_______g。
(2)该混合溶液中CuCl2的物质的量浓度为_____molL﹣1,将该混合溶液加水稀释至体积为1 L,稀释后溶液中Cu2+的物质的量浓度为_______molL﹣1。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“84”消毒液(主要成分为![]() )广泛应用于杀菌消毒。某化学学习小组用甲烷燃料电池电解饱和食盐水制备“84”消毒液,装置如图所示,
)广泛应用于杀菌消毒。某化学学习小组用甲烷燃料电池电解饱和食盐水制备“84”消毒液,装置如图所示,![]() ,
,![]() ,
,![]() ,
,![]() 均为惰性电极,下列说法正确的是( )
均为惰性电极,下列说法正确的是( )
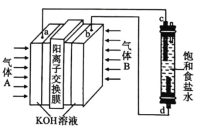
A.气体B为甲烷
B.电解装置中的总反应为NaCl+H2O![]() NaClO+H2↑
NaClO+H2↑
C.消耗2.24L(标准状况)甲烷,K+通过交换膜向左室移动0.8mol
D.甲烷发生的电极反应方程式为CH4-8e-+8OH—=CO2↑+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,40 g、10%硝酸钠溶液与60 g、7.5%的硝酸钠溶液混合,得到密度为1.20 g·cm-3的混合溶液,计算:
(1)该混合溶液中溶质的质量分数为__;
(2)该混合溶液中NaNO3的物质的量浓度为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一处于平衡状态的反应X(g) +3Y(g)![]() 2Z(g) (正反应是放热反应) 。为了使平衡向生成Z的方向移动, 应选择的条件是
2Z(g) (正反应是放热反应) 。为了使平衡向生成Z的方向移动, 应选择的条件是
①升高温度 ②降低温度 ③增大压强 ④降低压强 ⑤加入正催化剂 ⑥分离出Z
A. ①③⑤ B. ②③⑤ C. ②③⑥ D. ②④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为2L的恒容密闭容器中发生反应xA(g)+yB(g)![]() zC(g),图1表示200℃时容器中A、B、C的物质的量随时间的变化关系,图2表示不同温度下达到平衡时C的体积分数随起始
zC(g),图1表示200℃时容器中A、B、C的物质的量随时间的变化关系,图2表示不同温度下达到平衡时C的体积分数随起始![]() 的变化关系。则下列结论正确的是( )
的变化关系。则下列结论正确的是( )
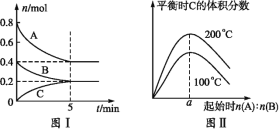
A.200℃时,反应从开始到平衡的平均速率v(B)=0.04mol·L-1·min-1
B.由图2可知反应xA(g)+yB(g)![]() zC(g)的ΔH<0,且a=2
zC(g)的ΔH<0,且a=2
C.若在图1所示的平衡状态下,再向体系中充入He,重新达到平衡前v(正)>v(逆)
D.200℃时,向容器中充入2molA和1molB,达到平衡时,A的体积分数小于0.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于胶体的叙述中,不正确的是( )
A.![]() 胶体能吸附水中的悬浮颗粒并沉降,常用于净水
胶体能吸附水中的悬浮颗粒并沉降,常用于净水
B.浊液、胶体、溶液的本质区别是分散质粒子的直径大小
C.用激光笔照射![]() 溶液和
溶液和![]() 胶体时,产生的现象相同
胶体时,产生的现象相同
D.胶态磁流体治癌术是将磁性物质制成胶体粒子,这种粒子的直径在![]() 之间
之间![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上,常采用氧化还原方法处理尾气中的CO、NO。
(氧化处理法)沥青混凝土可作为反应:2CO(g)+O2(g)![]() 2CO2(g)的催化剂。
2CO2(g)的催化剂。
图甲表示在相同的恒容密闭容器、相同起始浓度、相同反应时间段下,使用同质量的不同沥青混凝土(α型、β型)催化时,CO的转化率与温度的关系。
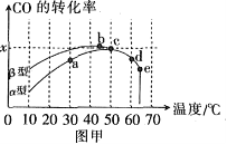
(1)在a、b、c、d四点中,未达到平衡状态的是___。
(2)已知c点时容器中O2浓度为0.04mol·L-1,则50℃时,在α型沥青混凝土中CO转化反应的平衡常数K=___(用含x的代数式表示)。
(3)下列关于图甲的说法正确的是__。
A.CO转化反应的平衡常数K(a)<K(c)
B.在均未达到平衡状态时,同温下β型沥青混凝土中CO转化速率比α型要大
C.b点时CO与O2分子之间发生有效碰撞的几率在整个实验过程中最高
D.e点转化率出现突变的原因可能是温度升高后催化剂失去活性
(还原处理法)某含钴催化剂可以催化消除柴油车尾气中的碳烟(C)和NOx。不同温度下,将模拟尾气(含0.025molNO、0.5molO2和足量碳烟)以相同的流速通过该催化剂,测得所有产物(CO2、N2、N2O)与NO的相关数据,结果如图乙所示。
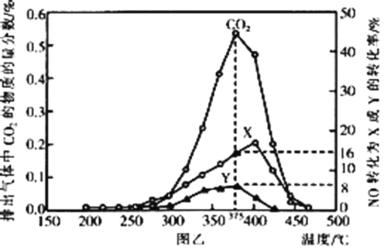
(4)375℃时,测得排出的气体中含0.45molO2和0.052molCO2,则Y的化学式为___。
(5)实验过程中采用NO模拟NOx,而不采用NO2的原因是___。
(6)工业上常用高浓度的K2CO3溶液吸收CO2,再利用电解法使K2CO3溶液再生,其装置示意图如图:
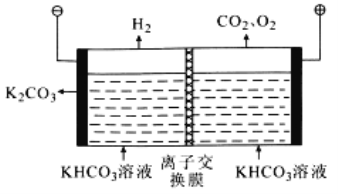
①在阳极区发生的反应包括___和H++HCO3- =CO2↑+H2O
②简述CO32-在阴极区再生的原理:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是石蜡油在炽热碎瓷片的作用下产生乙烯并检验乙烯性质的实验,请回答下列问题:

(1)A中碎瓷片的作用是________。
(2)B装置中反应的化学方程式为__________。
(3)C装置中可观察到的现象是_________。
(4)查阅资料.乙烯与酸性高锰酸钾溶液反应产生二氧化碳,根据本实验中装置_____(填装置字母)中的实验现象可判断该资料是否直实。
(5)通过上述实验探究,检验甲烷和乙烯的方法是_______(填字母,下同),除去甲烷中乙烯的方法是___。
A 气体通入水中 B 气体通过盛溴水的洗气瓶
C 气体通过盛酸性高锰酸钾溶液的洗气瓶 D 气体通过氢氧化钠溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com