
【题目】2Zn(OH)2ZnCO3是制备活性ZnO的中间体,以锌焙砂(主要成分为ZnO,含少量Cu2+、Mn2+等离子)为原料制备2Zn(OH)2ZnCO3的工艺流程如图: 
请回答下列问题:
(1)当(NH4)2SO4 , NH3H2O的混合溶液中存在c(NH4+)=2c(SO42﹣)时,溶液呈(填“酸”、“碱”或“中”)性.
(2)“浸取”时为了提高锌的浸出率,可采取的措施是(任写一种).
(3)“浸取”时加入的NH3H2O过量,生成MnO2的离子方程式为 .
(4)适量S2﹣能将Cu2+等离子转化为硫化物沉淀而除去,若选择ZnS进行除杂,是否可行?用计算说明原因: . [已知:Ksp(ZnS)=1.6×10﹣24 , Ksp(CuS)=1.3×10﹣36]
(5)“沉锌”的离子方程式为 .
(6)“过滤3”所得滤液可循环使用,其主要成分的化学式是 .
【答案】
(1)中;中
(2)搅拌、适当加热
(3)Mn2++H2O2+2NH3?H2O=MnO2↓+2NH4++2H2O
(4)可行,ZnS+Cu2+=CuS+Zn2+K= ![]() =1.2×1012>>1×105
=1.2×1012>>1×105
(5)3Zn2++6HCO3﹣=2Zn(OH)2?ZnCO3↓+5CO2↑+H2O
(6)(NH4)2SO4
【解析】解:制备2Zn(OH)2ZnCO3流程为:锌焙砂(主要成分为ZnO,含少量Cu2+、Mn2+等离子)中加入硫酸铵、氨水、双氧水,双氧水将锰离子氧化成二氧化锰,过滤后在滤液中加硫化铵,再过滤,除去铜离子,蒸氨除去多余的氨气,加入碳酸氢铵得到2Zn(OH)2ZnCO3和二氧化碳气体,过滤得2Zn(OH)2ZnCO3 , 滤液为硫酸铵溶液,(1)NH4)2SO4与NH3H2O的混合溶液中存在电荷守恒:c (NH4+)+c(H+)=2c(SO42﹣)+c(OH﹣),当c(NH4+)=2c(SO42﹣)时,c(H+)=c(OH﹣),即溶液显中性, 所以答案是:中;(2)根据影响反应速率的因素判断“浸取”时为了提高锌的浸出率,可采取的措施为搅拌、适当加热,
所以答案是:搅拌、适当加热;(3)“浸取”时加入的NH3H2O过量,溶液呈碱性,双氧水将锰离子氧化成MnO2 , 反应的离子方程式为Mn2++H2O2+2NH3H2O=MnO2↓+2NH4++2H2O,
所以答案是:Mn2++H2O2+2NH3H2O=MnO2↓+2NH4++2H2O;(4)根据反应ZnS+Cu2+=CuS+Zn2+ , 可知K= ![]() =1.2×1012>>1×105 , K>105化学反应完全,所以选择ZnS进行除杂是可行的,
=1.2×1012>>1×105 , K>105化学反应完全,所以选择ZnS进行除杂是可行的,
所以答案是:可行,ZnS+Cu2+=CuS+Zn2+ K= ![]() =1.2×1012>>1×105;(5)“沉锌”的过程为溶液中的锌离子与碳酸氢铵溶液反应生成2Zn(OH)2ZnCO3 , 离子方程式为3Zn2++6HCO3﹣=2Zn(OH)2ZnCO3↓+5CO2↑+H2O,
=1.2×1012>>1×105;(5)“沉锌”的过程为溶液中的锌离子与碳酸氢铵溶液反应生成2Zn(OH)2ZnCO3 , 离子方程式为3Zn2++6HCO3﹣=2Zn(OH)2ZnCO3↓+5CO2↑+H2O,
所以答案是:3Zn2++6HCO3﹣=2Zn(OH)2ZnCO3↓+5CO2↑+H2O;(6)“过滤3”所得滤液为硫酸铵溶液,可循环使用,其化学式为(NH4)2SO4 ,
所以答案是:(NH4)2SO4 .


 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案科目:高中化学 来源: 题型:
【题目】氧化铁黄(化学式为FeOOH)是一种黄色颜料,工业上用废铁为主要原料生产氧化铁黄的一种工艺流程如下: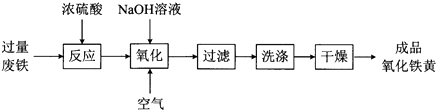
(1)氧化铁黄中铁元素的化合价为 , 废铁在反应前常用热的纯碱溶液清洗表面油污,其原理是(写离子方程式).
(2)氧化过程生成氧化铁黄的化学方程式是 .
(3)上述流程中,检验“洗涤”是否完全的方法是 .
(4)氧化时应控制pH的合理范围是3.5﹣4.0,pH过小导致氧化铁黄产率较低的可能原因是 .
(5)取1g样品进行纯度测试,将其溶解于足量稀盐酸中,后用一定浓度的过量NaOH溶液沉淀其中的铁元素,得到沉淀的质量为Bg,试用所给数据求出产品的纯度 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近科学家发现了氧元素的一种新的粒子O4。对于这种新粒子,下列说法不正确的是( )
A. 它与氧气互为同素异形体B. 它是氧元素的一种同位素
C. 它的摩尔质量是64 g·mol-1D. 它可能具有很强的氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,通常不能作为判断两种元素非金属性强弱的依据的是( )
A. 其气态氢化物的稳定性B. 单质的氧化性的强弱
C. 其最高价氧化物对应的水化物的酸性D. 单质的熔点高低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新制氯水与久置的氯水相比较,下列结论不正确的是 ( )
A. 颜色相同 B. 前者能使有色布条褪色
C. 都含有H+ D. 加AgNO3溶液都能生成白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据化学变化的实质是旧的化学键断裂、新的化学键形成这一理论,判断下列变化是化学变化的是( )
A. 固体氯化钠溶于水
B. 氯化铵受热分解生成氯化氢和氨气
C. 冰经加热变成水蒸气
D. 氯化氢溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用水稀释0.1 mol·L-1氨水时,溶液中随水量的增加而减小的是 ( )。
A.c(OH-)/c(NH3·H2O)
B.c(NH3·H2O)/c(OH-)
C.n(OH-)和c(H+)
D.c(H+)和c(OH-)的乘积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质反应后一定没有+3价铁生成的是( )
A. 过量的Fe与Cl2加热时发生反应
B. Fe与过量稀盐酸反应
C. FeCl2溶液中加少量硝酸
D. Fe和Fe2O3的混合物溶于盐酸中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组设计了如图装置证明和比较SO2和氯水的漂白性,其中B、D中为品红溶液,C中为NaOH溶液. 
(1)该化学兴趣小组同学为制取Cl2和SO2气体,现采用Na2SO3与70%的浓硫酸为原料制取SO2 , 采用MnO2和浓盐酸(12mol/L)为原料制取Cl2 . 请写出制取Cl2的离子方程式:
(2)反应开始后,发现B、D两个装置中的品红溶液都褪色,停止通气后,取B、D溶液于试管中分别加热,两个试管中的现象分别为:BD . 解释B中对应现象的原因 .
(3)装置C的作用是
(4)该实验小组的甲、乙两位同学利用上述两发生装置按下图装置继续进行实验: 
通气一段时间后,甲同学实验过程中品红溶液几乎不褪色,而乙同学的实验现象是品红溶液随时间的推移变得越来越浅.试根据该实验装置和两名同学的实验结果回答问题.
①两同学在气体进入品红溶液之前,先将气体通过F装置,F中可盛装浓硫酸.其目的是使SO2和Cl2混合均匀并且 .
②试分析甲同学实验过程中,品红溶液不褪色的原因是: . (用离子方程式说明)
③你认为乙同学是怎样做到让品红溶液变得越来越浅的? .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com