
| A. | 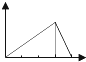 | B. | 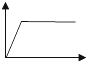 | C. | 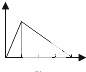 | D. | 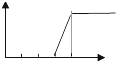 | ||||
| E. | 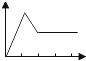 |
科目:高中化学 来源: 题型:多选题
| A. | KOH═K++OH- | B. | NaHCO3═Na++H++CO32- | ||
| C. | H2SO4═2H++SO42- | D. | Fe2(SO4)3═Fe23++3SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
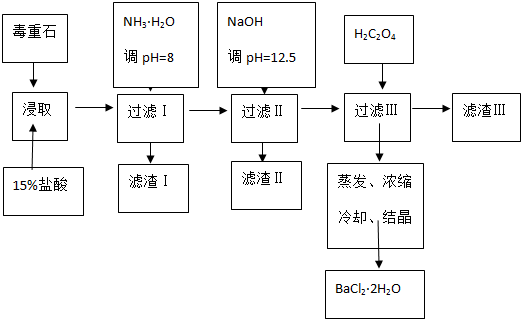
| Ca2+ | Mg2+ | Fe3+ | |
| 开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
| 完全沉淀时的pH | 13.9 | 11.1 | 3.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 | 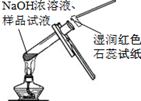 | 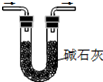 | 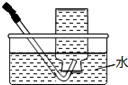 |
| A.将NaOH溶液存 放在玻璃瓶中 | B.检验试液中NH4+ 的存在 | C.干燥CO2气体 | D.收集NH3气体 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,其六氯代物有3种;
,其六氯代物有3种;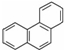 ,其二氯代物的数目为25种;
,其二氯代物的数目为25种; ),其二氯代物有16种.
),其二氯代物有16种.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
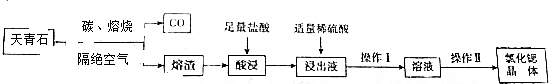
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com