
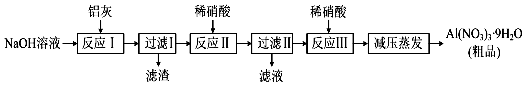
分析 铝灰用氢氧化钠溶液溶解,铝、氧化铝反应生成偏铝酸钠,氧化铁不反应,过滤分离,滤液中含有偏铝酸钠、未反应的NaOH,加入硝酸中和未反应的氢氧化钠,并将偏铝酸钠转化为氢氧化铝沉淀,再过滤分离,氢氧化铝沉淀再用硝酸溶解,得到硝酸铝溶液,经过减压蒸发得到硝酸铝晶体,以此解答该题.
解答 解:(1)氧化铁与氢氧化钠溶液不反应,则过滤Ⅰ得到的滤渣主要成份是Fe2O3,故答案为:Fe2O3;
(2)反应Ⅰ涉及铝与氢氧化钠反应生成偏铝酸钠与氢气,氧化铝与氢氧化钠反应生成偏铝酸钠与水,其中生成气体的反应方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(3)加入硝酸生成氢氧化铝,如硝酸过量,则生成硝酸铝,导致滤液中含有硝酸铝,应在滤液Ⅰ中通入二氧化碳气体,可生成氢氧化铝,并避免氢氧化铝的溶解,
故答案为:硝酸过量可导致氢氧化铝溶解;通入二氧化碳;
(4)温度高于200℃时,硝酸铝完全分解成氧化铝和两种气体,两种气体应是二氧化氮与氧气,二者体积之比为4:1,满足原子守恒与电子转移守恒,反应方程式为:4Al(NO3)3$\frac{\underline{\;\;△\;\;}}{\;}$2Al2O3+12NO2↑+3O2↑,
故答案为:4Al(NO3)3$\frac{\underline{\;\;△\;\;}}{\;}$2Al2O3+12NO2↑+3O2↑.
点评 本题考查实验制备方案,为高考常见题型,侧重考查是对工艺流程的理解、分析与评价,是对学生综合能力的考查,需要学生具备知识的基础与灵活运用的能力,难度中等.


 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:选择题
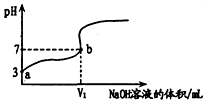 常温下,用0.1000mol/L的NaOH溶液滴定20mL同浓度的一元弱酸HA,滴定过程溶液pH随NaOH溶液的体积的变化曲线如图所示(忽略中和热效应).下列说法不正确的是( )
常温下,用0.1000mol/L的NaOH溶液滴定20mL同浓度的一元弱酸HA,滴定过程溶液pH随NaOH溶液的体积的变化曲线如图所示(忽略中和热效应).下列说法不正确的是( )| A. | 常温下,HA的电离常数K(HA)约为10-5 | |
| B. | v1<20 | |
| C. | 溶液中水的电离程度:a点>b点 | |
| D. | 滴定过程为了确定滴定终点,最合适的指示剂是酚酞 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
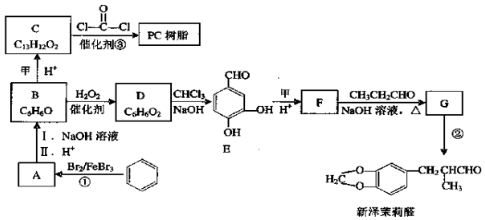
 +H2O
+H2O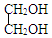 $\stackrel{H+}{→}$
$\stackrel{H+}{→}$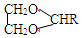 +H2O
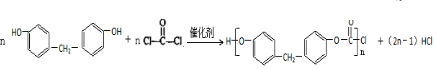
+H2O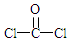 +2ROH$\stackrel{催化剂}{→}$
+2ROH$\stackrel{催化剂}{→}$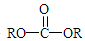 +2HCl
+2HCl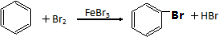 .
. .
. .
. .
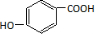
.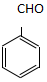 )为原料,选用必要的无机试剂合成
)为原料,选用必要的无机试剂合成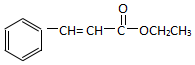 ,写出合成路线
,写出合成路线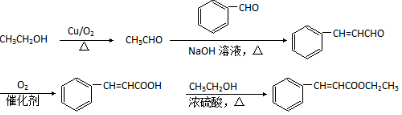 (用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件).
(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂是热值最高的营养物质,可以制造肥皂和油漆 | |
| B. | 利用二氧化碳制造全降解塑料,符合绿色化学理念 | |
| C. | 脱脂棉、滤纸、蚕丝的主要成分均为纤维素,完全水解能得到葡萄糖 | |
| D. | 酒精、福尔马林用于杀菌消毒的原理都是使蛋白质变性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇与浓H2SO4共热170℃ | B. | 乙烯使溴水褪色 | ||
| C. | 甲苯与浓硫酸、浓硝酸混合 | D. | 苯与Cl2一定条件生成六氯环己烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
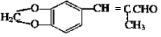
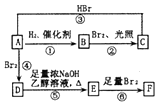 烯烃A在一定条件下可以按下而的流程进行反应.
烯烃A在一定条件下可以按下而的流程进行反应.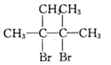
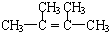 .
.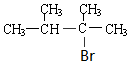 .
.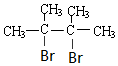 +2NaOH$→_{△}^{乙醇}$
+2NaOH$→_{△}^{乙醇}$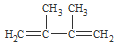 +2NaBr+2H2O.
+2NaBr+2H2O.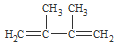 +2Br2→
+2Br2→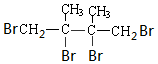 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在食品中加入着色剂 | B. | 轮船船身装锌块防腐 | ||
| C. | 在糕点包装内放置抗氧化剂 | D. | 燃煤发电时用煤粉代替煤块 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
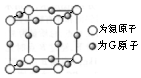 A、B、C、D、E、F、G是前四周期(除稀有气体)原子序数依次增大的七种元素,A的原子核外电子只有一种运动状态;B、C的价电子层中未成对电子数都是2;D、E、F同周期;E核外的s、p能级的电子总数相筹;F与E同周期且第一电离能比E小;G的+1价离子(G+)的各层电子全充满.回答问题:
A、B、C、D、E、F、G是前四周期(除稀有气体)原子序数依次增大的七种元素,A的原子核外电子只有一种运动状态;B、C的价电子层中未成对电子数都是2;D、E、F同周期;E核外的s、p能级的电子总数相筹;F与E同周期且第一电离能比E小;G的+1价离子(G+)的各层电子全充满.回答问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com