
【题目】(1)汽车剧烈碰撞时,安全气囊中发生反应NaN3+KNO3→K2O+Na2O+X↑(未配平),已知X为单质,在反应中NaN3失去电子.则该反应的氧化剂为______,X的化学式为______.
(2)工业上制取高纯度MnO2的某一步骤如图所示:
![]()
请写出该反应的离子方程式__ ___.
(3)草酸钙晶体(CaC2O4H2O)可用作分离稀有金属的载体.
①在一定温度下向2L的密闭容器放入足量草酸钙(固体所占体积忽略不计)发生反应:CaC2O4(s)CaO(s)+CO(g)+CO2(g),若前5min内生成CaO的质量为11.2g,则该段时间内v(CO)=__________molL﹣1min﹣1;当反应达到平衡后,将容器体积压缩到原来的一半,则下列说法正确的是__________(填答案选项编号).
A.平衡不移动,CaO的质量不变
B.平衡发生移动,且CaC2O4的分解率增大
C.平衡发生移动,但CO和CO2的浓度都没有改变
D.平衡向逆反应方向移动,且该反应的化学平衡常数减小
②某温度下,向0.3mol/L的Na2CO3溶液中加入足量CaC2O4粉末后(忽略溶液体积变化),充分搅拌,发生反应:CO32﹣(aq)+CaC2O4(s)CaCO3(s)+C2O42﹣(aq).静置后沉淀转化达到平衡.求此时溶液中的c(C2O42﹣)= molL﹣1.已知:该温度下,KSP(CaC2O4)=5.0×10﹣9;KSP(CaCO3)=2.5×10﹣9.
【答案】(1)KNO3,N2;
(2)5Mn2++2ClO3﹣+4H2O=5MnO2↓+Cl2↑+8H+;
(3)①0.02molL﹣1min﹣1;C;②0.2 mol/L。
【解析】
试题分析:(1)根据反应方程式,以及原子守恒,X为单质,则X为N2,化合价降低的是氧化剂,化合价升高的还原剂,K、Na、O的化合价没有发生变化,NaN3失去电子,KNO3中N得到电子,即KNO3是氧化剂;(2)根据步骤,其离子反应是Mn2++ClO3-→MnO2↓+Cl2↑,Mn的化合价由+2价→+4价,化合价升高2价,ClO3-中Cl的化合价由+5价→0价,化合价降低5价,Cl元素共降低10价,最小公倍数为10,即Mn2+和MnO2的系数为5,即5Mn2++2ClO3-→5MnO2↓+Cl2↑,因此根据元素守恒和电荷守恒,离子反应方程式为:5Mn2++2ClO3﹣+4H2O=5MnO2↓+Cl2↑+8H+;(3)①根据反应方程式,生成n(CO)=11.2/56mol=0.2mol,根据化学反应速率的表达式,v(CO)=0.2/(2×5)mol/(L·min)=0.02mol/(L·min),A、体积压缩一半,压强增大,根据勒夏特列原理,平衡向逆反应方向移动,CaO的质量减小,故错误;B、根据A的分析,平衡向逆反应方向移动,即CaC2O4的分解率降低,故错误;C、根据平衡常数的表达式:K=c(CO2)×c(CO),平衡常数只受温度的影响,温度不变则化学平衡常数不变,因此两者浓度不变,故正确;D、根据选项C的分析,故错误;②设有c(CO32-)转化了x,则生成c(C2O42-)=x,剩余c(CO32-)=(0.3-x),平衡常数K=c(C2O42-)/c(CO32-)=Ksp(CaC2O4)·K-1sp(CaCO3),代入数值,得出x=0.2mol·L-1。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某恒温密闭容器发生可逆反应:Z(?)+W(?)![]() X(g)+Y(?) ΔH,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件。下列有关说法中正确的是( )
X(g)+Y(?) ΔH,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件。下列有关说法中正确的是( )
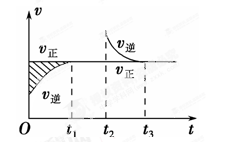
A.Z和W在该条件下均为非气态
B.t1~t2时间段与t3时刻后,两时间段反应体系中气体的平均摩尔质量不可能相等
C.若在该温度下此反应平衡常数表达式为K=c(X),则 t1~t2时间段与t3时刻后的X浓度不相等
D.若该反应只在某温度T以上自发进行,则该反应的平衡常数K随温度升高而减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备白色的Fe(OH)2沉淀:
(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需加入稀硫酸和铁屑,请写出加入铁屑的原因:___________。
(2)除去蒸馏水中溶解的O2常采用的方法___________。
(3)生成白色Fe ( OH )2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是:_________________。
(4)下列各图示中能较长时间看到Fe ( OH )2白色沉淀的是_________(填序号)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列过程能使蛋白质变性的是
A.蛋白质中加NA2SO4后析出蛋白质 B.蛋白质用福尔马林浸泡
C.蛋白质中加PB(AC)2后析出蛋白质固体 D.蛋白质中遇X光后
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,在300℃、70MPa下由二氧化碳和氢气合成乙醇已成为现实。2CO2(g)+6H2(g) ![]() CH3CH2OH(g)+3H2O(g) 下列叙述错误的是
CH3CH2OH(g)+3H2O(g) 下列叙述错误的是
A.使用Cu-Zn-Fe催化剂可大大提高乙醇的产率
B.充入大量CO2气体可提高H2的转化率
C.加压可以增大正、逆反应速率,使平衡向正反应方向移动
D.从平衡混合气体中分离出CH3CH2OH和H2O可提高CO2和H2的利用率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列由实验得出的结论正确的是
实验 | 结论 | |
A. | 将乙烯通入溴的四氧化碳溶液,溶液最终变为无色透明 | 生成的1,2—二溴乙烷无色、可溶于四氧化碳 |
B. | 乙醇和水都可与金属钠反应产生可燃性气体 | 乙醇分子中的氢与水分子中的氢具有相同的活性 |
C. | 用乙酸浸泡水壶中的水垢,可将其清除 | 乙酸的酸性小于碳酸的酸性 |
D. | 甲烷与氯气在光源下反应后的混合气体能使湿润的石蕊试纸变红 | 生成的氯甲烷具有酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一恒容密闭烧瓶中注入NO2,在25℃时建立平衡:2NO2![]() N2O4 △ H<0。若把烧瓶置于100℃的沸水中,下列情况:①颜色 ②平均摩尔质量 ③质量 ④压强 ⑤密度中不变的是
N2O4 △ H<0。若把烧瓶置于100℃的沸水中,下列情况:①颜色 ②平均摩尔质量 ③质量 ④压强 ⑤密度中不变的是
A. ③⑤ B. ③④ C. ②④ D. ①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学在生产、生活中有着广泛的应用,下列物质的化学性质与应用的对应关系正确的是
化学性质 | 应用 | |
A | 0价铁具有还原性 | 铁粉可用于食品中的脱氧剂 |
B | 明矾与NaOH生成Al(OH)3 | 明矾可作净水剂 |
C | Fe的金属性比Cu活泼 | FeCl3浓溶液腐蚀Cu刻制印刷电路板 |
D | NaHCO3水解显碱性 | 发酵粉中含有NaHCO3 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com