
| A. | 升温水的离子积增大 | |
| B. | pH=7的溶液一定显中性 | |
| C. | NaHSO4 溶液一定显酸性 | |
| D. | 用氢氧化钠溶液滴定硫酸溶液到滴定终点时,混合溶液不一定显中性 |
分析 A.水的电离是吸热过程,升温促进电离平衡正向进行;
B.水的电离为吸热反应,温度影响水的离子积,温度升高,水电离出氢离子浓度增大;
C.NaHSO4是强酸酸式盐,为强电解质,在水溶液中电离方程式为NaHSO4=Na++H++SO42-,导致溶液中c(H+)>c(OH-);
D.滴定终点的指示剂变色范围分析;
解答 解;A.水的电离是吸热过程,升温促进电离平衡正向进行,离子积常数增大,故A正确;
B.溶液的酸碱性是根据溶液中H+浓度与OH-浓度的相对大小,当c(H+)=c(OH-),溶液呈中性.常温下,水的离子积Kw=1×10-14,所以pH<7,溶液呈酸性;pH=7,溶液呈中性;pH>7,溶液呈碱性.Kw受温度影响,水的电离是吸热的,温度越高Kw越大,如100℃时,水的离子积常数是10-12,当pH=6时溶液呈中性,此时pH=7时溶液呈碱性,该选项中pH=7的溶液,不一定是在常温下,溶液中c(H+)、c(OH-)不一定相等,故B错误;
C.NaHSO4是强酸酸式盐,为强电解质,在水溶液中电离方程式为NaHSO4=Na++H++SO42-,导致溶液中c(H+)>c(OH-),则该溶液呈酸性,故C正确;
D.用氢氧化钠溶液滴定硫酸溶液到滴定终点时,指示剂指示反应终点的变色不一定正好在PH=7,所以混合溶液不一定显中性,故D正确;
故选B.
点评 本题考查了溶液酸碱性的判断方法,解题关键是抓住溶液呈酸碱性是氢离子和氢氧根离子的相对大小、离子积常数随温度变化,题目难度不大.


科目:高中化学 来源: 题型:选择题
| 类别选项 | 碱 | 盐 | 电解质 | 非电解质 |
| A | 烧碱 | 小苏打 | BaSO4 | 干冰 |
| B | 纯碱 | CaCO3 | NH3•H2O | Fe |
| C | 明矾 | 食盐 | 石墨 | 醋酸 |
| D | KOH | CuSO4 | Na2SO4 | KClO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有NH4+、Cl-、H+、OH-的溶液中,离子浓度一定是c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | 常温下,pH=6的醋酸与醋酸钠的混合溶液中:c(Na+)>c(CH3COO-) | |
| C. | 将0.2 mol•L-1 CH3COOH溶液和0.1 mol•L-1 NaOH溶液等体积混合,则反应后的混合溶液中:2c(OH-)+c(CH3COO-)═2c(H+)+c(CH3COOH) | |
| D. | 常温下pH=6的NH4Cl溶液中:c(Cl-)>c(NH4+)>c(NH3•H2O)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食物溶于水后的溶液pH<7,则称为酸性食物 | |
| B. | 由碳、氮、硫、磷等元素组成的蛋自质是酸性食物 | |
| C. | 蔬菜、水果是酸性食物 | |
| D. | 柠檬酸是酸性食物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大力实施矿物燃料“脱硫、脱硝”技术,可减少酸雨的发生 | |
| B. | SiO2具有很好的导电性,可用于制取光导纤维 | |
| C. | 节日燃放的烟花,是碱金属、锶、铂、铁等金属化合物焰色反应所呈现的色彩 | |
| D. | CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
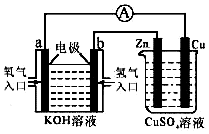 由化学能转变的热能或电能仍然是人类使用的主要能源,根据如图所示的装置,(其中a、b均为石墨电极)
由化学能转变的热能或电能仍然是人类使用的主要能源,根据如图所示的装置,(其中a、b均为石墨电极)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
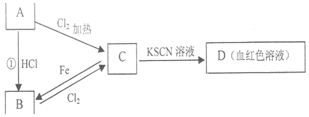 A、B、C、D四种物质都含有一种共同的元素,A是常见的金属,C的溶液呈现黄色,A、B、C、D之间有如图所示转化关系.试回答下列问题:
A、B、C、D四种物质都含有一种共同的元素,A是常见的金属,C的溶液呈现黄色,A、B、C、D之间有如图所示转化关系.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 用铂丝蘸取少量无色溶液进行焰色反应 | 火焰呈黄色 | 该溶液是钠盐溶液 |
| B | 向Fe(NO3)2溶液中滴加稀硫酸,再滴加几滴KSCN溶液 | 溶液变红色 | 稀硫酸能氧化Fe(NO3)2 |
| C | 向AgCl悬浊液加入NaI溶液 | 出现黄色沉淀 | Ksp(AgCl)<Ksp(AgI) |
| D | 向KI溶液中加入新制氯水和CCl4,C充分振荡、静置 | 液体分层,下层紫红色 | Cl2的氧化性强于I2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com