
设NA为阿伏加德罗常数的值,下列说法正确的是
A.78 g Na2O2与足量水反应转移电子数为NA
B.标准状况时,22.4 L水含氢原子数为2NA
C.1mol氦气所含原子个数为 2 NA
D.在25℃,101KPa 下, 2 g H2所含质子个数为 NA
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源:2014-2015学年河南省高一上学期期中考试化学试卷(解析版) 题型:选择题
中国科学技术大学的钱逸泰教授等以CCl4和金属钠为原料,在700oC时反应制造出纳米级金刚石粉末和另一种化合物。该成果发表在世界权威的《科学》杂志上,立即被科学家们高度评价为“稻草变黄金”。同学们对此有下列一些“理解”,你认为其中错误的是
A.金刚石属于金属单质 B.制造过程中元素种类没有改变
C.另一种化合物为NaCl D.这个反应是氧化还原反应
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省高一上学期期中考试化学试卷(解析版) 题型:选择题
下列各组中的离子,能在溶液中大量共存的是
A.Na+、Mg2+、SO42-、Cl
B.Na+、Ca2+、CO32-、NO3-
C.Na+、H+、Cl-、CO32-
D.K+、Fe3+、SO42-、OH-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省英文学校高二10月月考化学试卷(解析版) 题型:填空题
(8分)煤燃烧的反应热可通过以下两种途径来利用:
a.利用煤在充足的空气中直接燃烧产生的反应热;
b.先使煤与水蒸气反应得到氢气和一氧化碳,然后使得到的氢气和一氧化碳在充足的空气中燃烧。这两个过程的热化学方程式为:a.C(s)+O2(g)===CO2(g) ΔH=E1①,b.C(s)+H2O(g)===CO(g)+H2(g) ΔH=E2②,H2(g)+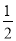 O2(g)===H2O(g) ΔH=E3③,CO(g)+
O2(g)===H2O(g) ΔH=E3③,CO(g)+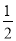 O2(g)===CO2(g) ΔH=E4④
O2(g)===CO2(g) ΔH=E4④
回答:(1)与途径a相比途径b有较多的优_______________________________
(2)上述四个热化学方程式中的哪个反应ΔH>0________。
(3)等质量的煤分别通过以上两条不同的途径产生的可利用的总能量关系正确的是________。
A.a比b多 B.a比b少[来源C.a与b在理论上相同
(4)根据能量守恒定律,E1、E2、E3、E4之间的关系为______________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省英文学校高二10月月考化学试卷(解析版) 题型:选择题
10.已知热化学方程式:
(1)2H2O(l)===2H2(g)+O2(g) ΔH=+571.6 kJ·mol-1
(2)2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ·mol-1
当1 g液态水变为气态水时,对其热量变化有下列描述:①放出;②吸收;③2.44 kJ;④4.88 kJ;⑤88 kJ。其中正确的是
A.②和⑤ B.①和③ C.②和③ D.②和④
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省英文学校高一10月月考化学试卷(解析版) 题型:选择题
已知Q与R的摩尔质量之比为9∶22,在反应X+2Y===2Q+R中,当1.6g X与Y完全反应后,生成4.4g R,则参与反应的Y和生成物Q的质量之比为( )
A.46∶9 B.16∶9 C.23∶9 D.32∶9
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南周口市高二上第一次月考化学(解析版) 题型:选择题
对已达化学平衡的下列反应 2X(g)+ Y(g)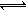 2Z(g),减小压强时,对反应产生的影响是
2Z(g),减小压强时,对反应产生的影响是
A .逆反应速率增大,正反应速率减小,平衡向逆反应方向移动
B.逆反应速率减小,正反应速率增大,平衡向正反应方向移动
C.正、逆反应速率都减小,平衡向逆反应方向移动
D .正、逆反应速率都增大,平衡向正反应方向移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com