
 ;
; ;
;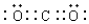 ;
; ;
;分析 (1)氯化铵为离子晶体,由氨根离子与氯离子通过离子键结合在一起,铵根离子内部,氮原子与氢原子通过共价键结合,氯化铵含有离子键和共价键;
(2)Na2O2是离子化合物,由Na+离子和O22-离子构成,过氧根离子内部两个氧原子共用一对电子,过氧化钠含有离子键和共价键;
(3)二氧化碳中存在两对碳氧共用电子对,二氧化碳只含共价键;
(4)氯化镁是离子化合物,由镁离子与氯离子构成,注意电子式中相同离子不能合并,氯化镁只含离子键;
解答 (1)氯化铵是离子化合物,由氨根离子与氯离子构成,铵根离子内部,氮原子与氢原子通过共价键结合,电子式为: ,
,
故答案为: ;
;
(2)Na2O2是离子化合物,由Na+离子和O2-离子构成,过氧根离子内部两个氧原子共用一对电子,Na2O2的电子式为: ,
,
故答案为: ;
;
(3)二氧化碳中存在两对碳氧共用电子对,二氧化碳的电子式为: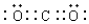 ,
,
故答案为: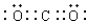 ;
;
(4)氯化镁是离子化合物,由镁离子与氯离子构成,电子式为 ,
,
故答案为: ;
;
氯化铵含有离子键和共价键;过氧化钠含有离子键和共价键;二氧化碳只含共价键;氯化镁只含离子键;
所以:1)~(6)中,仅含离子键的是(1)(2)(4),仅含共价键的是(3),既有离子键又有共价键的是(1)(2);
故答案为:(1)(2)(4);(3);(1)(2);
点评 本题考查了电子式的书写,注意掌握电子式的概念及书写原则,明确离子化合物与共价化合物的电子式表示方法及区别,题目难度不大.


科目:高中化学 来源: 题型:解答题
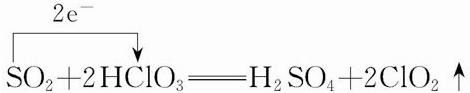 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 凡是分子组成相差一个或若干个CH2原子团的物质,彼此一定是同系物 | |
| B. | 分子式为C5H12O且氧化产物能发生银镜反应的醇有6种 | |
| C. | 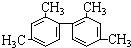 分子中至少有11个碳原子处于同一平面 分子中至少有11个碳原子处于同一平面 | |
| D. | 1mol β-紫罗兰酮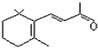 与1mol H2发生加成反应可得到3种不同产物 与1mol H2发生加成反应可得到3种不同产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 吸收92KJ | B. | 放出92kJ | C. | 吸收184kJ | D. | 放出184KJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ②④⑥ | C. | ①③⑤ | D. | ②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;反应类型:加聚反应.
;反应类型:加聚反应.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com