
设NA为阿伏伽德罗常数的值。下列说正确的是
A.高温下,0.2molFe与足量水蒸气反应,生成的H2分子数目为0.3NA
B.室温下,1LpH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA
C.氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA
D.5NH4NO3△2HNO3+4N2↑+9H2O反应中,生成28g N2时,转移的电子数目为3.75NA
D
【解析】
试题分析:A、高温下铁与水蒸气反应的化学方程式为3Fe+4H2O(g)△Fe3O4+4H2,因此高温下,0.2molFe与足量水蒸气反应,生成的H2分子数目为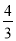 ×0.2 NA=0.27NA,A不正确;B、室温下,1LpH=13的NaOH溶液中,氢离子的物质的量是10-13,水电离出1个氢离子,必然电离出1个OH-离子,所以由水电离的OH-离子数目为10-13NA,B不正确;C、氢氧燃料电池正极消耗氧气,22.4L(标准状况)氧气的物质的量是1mol,氧气在反应中得到4个电子,则1mol氧气得到4mol电子,电路中通过的电子数目为4NA,C不正确;D、5NH4NO3△2HNO3+4N2↑+9H2O反应中,-3价的氮元素升高到0价,失去3个电子。+5价的氮元素降低到0价,得到5个电子,即每生成4mol氮气反应中转移电子的物质的量是15mol。因此生成28g N2即1mol氮气时,转移电子的物质的量是15mol÷4=3.75mol,其的电子数目为3.75NA,D正确,答案选D。
×0.2 NA=0.27NA,A不正确;B、室温下,1LpH=13的NaOH溶液中,氢离子的物质的量是10-13,水电离出1个氢离子,必然电离出1个OH-离子,所以由水电离的OH-离子数目为10-13NA,B不正确;C、氢氧燃料电池正极消耗氧气,22.4L(标准状况)氧气的物质的量是1mol,氧气在反应中得到4个电子,则1mol氧气得到4mol电子,电路中通过的电子数目为4NA,C不正确;D、5NH4NO3△2HNO3+4N2↑+9H2O反应中,-3价的氮元素升高到0价,失去3个电子。+5价的氮元素降低到0价,得到5个电子,即每生成4mol氮气反应中转移电子的物质的量是15mol。因此生成28g N2即1mol氮气时,转移电子的物质的量是15mol÷4=3.75mol,其的电子数目为3.75NA,D正确,答案选D。
考点:考查阿伏伽德罗常数的计算


 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源:2014年全国普通高等学校招生统一考试理科综合能力化学(新课标Ⅱ卷解析版) 题型:选择题
一定温度下,下列溶液的离子浓度关系式正确的是
A.pH=5的H2S溶液中,c(H+)= c(HS-)=1×10—5 mol·L—1
B.pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
C.pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:
c(Na+)+ c(H+)= c(OH-)+c( HC2O4-)
D.pH相同的①CH3COO Na②NaHCO3③NaClO三种溶液的c(Na+):①>②>③
查看答案和解析>>
科目:高中化学 来源:2014年全国普通高等学校招生统一考试理科综合能力化学(山东卷解析版) 题型:选择题
根据原子结构及元素周期律的知识,下列推断正确的是
A.同主族元素含氧酸的酸性随核电荷数的增加而减弱
B.核外电子排布相同的微粒化学性质也相同
C.Cl?、S2?、Ca2+、K+半径逐渐减小
D.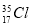 与
与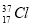 得电子能力相同
得电子能力相同
查看答案和解析>>
科目:高中化学 来源:2014年全国普通高等学校招生统一考试理科综合能力化学(天津卷解析版) 题型:选择题
已知:锂离子电池的总反应为:LixC+Li1-xCoO2 C+LiCoO2锂硫电池的总反应为:2Li+S
C+LiCoO2锂硫电池的总反应为:2Li+S Li2S
Li2S
有关上述两种电池说法正确的是
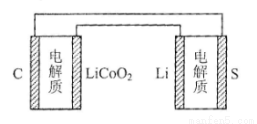
A.锂离子电池放电时,Li+向负极迁移
B.锂硫电池充电时,锂电极发生还原反应
C.理论上两种电池的比能量相同
D.右图表示用锂离子电池给锂硫电池充电
查看答案和解析>>
科目:高中化学 来源:2014年全国普通高等学校招生统一考试理科综合能力化学(四川卷解析版) 题型:推断题
(16分)A是一种有机合成中间体,其结构简式为: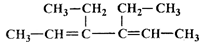 。A的合成路线如下图,其中B~H分别代表一种有机物。
。A的合成路线如下图,其中B~H分别代表一种有机物。
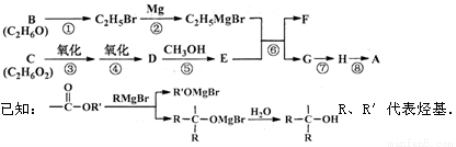
请回答下列问题:
(1)A中碳原子的杂化轨道类型有_____;A的名称(系统命名)是____;第⑧步反应类型是___。
(2)第①步反应的化学方程式是________。
(3)C物质与CH2=C(CH3)COOH按物质的量之比1:1反应,其产物经加聚得到可作隐形眼镜的镜片材料I。I的结构简式是_______________。
(4)第⑥步反应的化学方程式是________________。
(5)写出含有六元环,且一氯代物只有2种(不考虑立体异构)的A的同分异构体的结构简式____。
查看答案和解析>>
科目:高中化学 来源:2014年全国普通高等学校招生统一考试理科综合能力化学(北京卷解析版) 题型:填空题
(15分)用FeCl3酸性溶液脱除H2S后的废液,通过控制电压电解得以再生。某同学使用石墨电极,在不同电压(x)下电解pH=1的0.1mol/LFeCl2溶液,研究废液再生机理。记录如下(a、b、c代表电压值:)
序号 | 电压/V | 阳极现象 | 检验阳极产物 |
I | x≥a | 电极附近出现黄色,有气泡产生 | 有Fe3+、有Cl2 |
II | a>x≥b | 电极附近出现黄色,无气泡产生 | 有Fe3+、无Cl2 |
III | b>x>0 | 无明显变化 | 无Fe3+、无Cl2 |
(1)用KSCN溶液检验出Fe3+的现象是_______。
(2)I中,Fe2+产生的原因可能是Cl-在阳极放电,生成的Cl2将Fe2+氧化。写出有关反应的方程式_____。
(3)由II推测,Fe3+产生的原因还可能是Fe2+在阳极放电,原因是Fe2+具有_____性。
(4)II中虽未检测出Cl2,但Cl-在阳极是否放电仍需进一步验证。电解pH=1的NaCl溶液做对照实验,记录如下:
序号 | 电压/V | 阳极现象 | 检验阳极产物 |
IV | a>x≥c | 无明显变化 | 有Cl2 |
V | c>x≥b | 无明显变化 | 无Cl2 |
①NaCl溶液的浓度是________mol/L。
②IV中检测Cl2的实验方法:____________________。
③与II对比,得出的结论(写出两点):___________________。
查看答案和解析>>
科目:高中化学 来源:2014年全国普通高等学校招生统一考试理科综合能力化学(北京卷解析版) 题型:选择题
下列解释事实的方程式不正确的是( )
A.测0.1mol/L氨水的pH为11:NH3·H2O NH4++OH-
NH4++OH-
B.将Na块放入水中,产生气体:2Na+2H2O=2NaOH+H2↑
C.用CuCl2溶液做导电实验,灯泡发光:CuCl2  Cu2++2Cl-
Cu2++2Cl-
D.Al片溶于NaOH溶液中,产生气体:2Al+2OH-+2H2O=2AlO2-+3H2↑
查看答案和解析>>
科目:高中化学 来源:2014年全国普通高等学校招生统一考试理科综合能力化学(上海卷解析版) 题型:填空题
(本题共8分)
许多有机化合物具有酸碱性。
完成下列填空:
(1)苯酚、苯甲醇、苯甲酸、碳酸的酸性由强到弱的顺序为:_____________________________________。苯胺(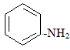 )具有______。(相同“酸性”、“碱性”或“中性”)
)具有______。(相同“酸性”、“碱性”或“中性”)
(2)常常利用物质的酸碱性分离混合液。某一混合液含苯酚、苯甲醇、苯甲酸和苯胺四种物质,其分离方案如下图:
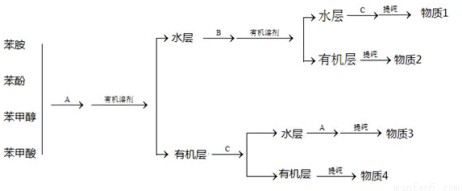
已知:苯甲醇、苯甲酸、苯胺微溶于水。
A、B、C分别是:A_______ B_________ C_____________
上述方案中,若首先仅仅将苯甲酸与其他三种物质分开,则应加入________。
(3)欲将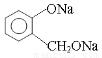 转化为
转化为 ,则应加入____________。
,则应加入____________。
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省原名校高三高考仿真模拟统一考试理综化学试卷(解析版) 题型:填空题
(17分)合成氨工业上常用下列方法制备H2 :
方法:
方法: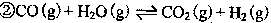
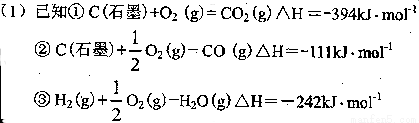
试计算25℃时由方法②制备l000g H2所放出的能量为_________ kJ。
(2)在一定的条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器,发生反应:
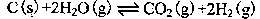 其相关数据如下表所示:
其相关数据如下表所示:
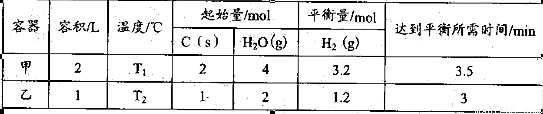
①T1_________T2 (填“>”、“=”或“<”);
T1℃时,该反应的平衡常数K=_________ 。
②乙容器中,当反应进行到1.5min时,H2O(g)的物质的量浓度范围是_________。
③一定条件下,在密闭恒容的容器中,能表示上述反应达到化学平衡状态的是_________。
A.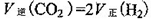
B.混合气体的密度保持不变

D.混合气体的平均相对分子质量保持不变
④某同学为了研究反应条件对化学平衡的影响,测得逆反应速率与时间的关系如图所示:
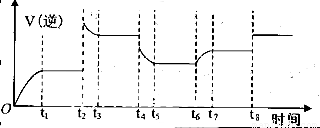
可见在t1、t3、t5、t7时反应都达了到平衡状态,如果t2、t4、t6、t8时都只改变了一个反应条件,则从t1到t8哪个时间段H2O (g)的平衡转化率最低_________,t4时刻改变的条件是__________。
⑤在25 ℃时,c mol/L,的醋酸与0.02mol/L NaOH溶液等体积混合后溶液刚好呈中性,
用含c的代数式表示CH3COOH的电离常数Ka=_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com