
| A. | 25℃时,1LpH=2的HCl溶液中,由水电离出的H+的数目0.01NA | |
| B. | 标准状况下,2.24L的CCl4中含有的氯原子数为0.4NA | |
| C. | 常温下,1molCO2中含有的共用电子对数目为2NA | |
| D. | 标准状况下,2.24L Cl2与水充分反应,转移的电子数小于0.1NA |
分析 A.在酸溶液中,水的电离被抑制;
B.四氯化碳在标况下不是气体;
C.1个二氧化碳分子中,碳和氧之间有4对共用电子对;
D.氯气与水的反应是一个可逆反应,不能进行彻底.
解答 解:A.在酸溶液中,水的电离被抑制,溶液中H+几乎全部来自于酸,而OH-全部来自于水,1LpH=2的HCl溶液中水电离出的n(H+)=n(OH-)=10-12mol/L×1L=10-12mol,故A错误;
B.四氯化碳在标况下不是气体,不能使用气体摩尔体积计算氯原子的数目,故B错误;
C.1个二氧化碳分子中,碳和氧之间有4对共用电子对,则1molCO2中含有的共用电子对数目为4NA,故C错误;
D.氯气与水的反应是一个可逆反应,不能进行彻底,Cl2+H2O?HCl+HClO,在标况下2.24LCl2物质的量为0.1mol,与水充分反应,转移的电子数小于0.1NA,故D正确;
故选D.
点评 本题考查了阿伏加德罗常数的有关计算,熟练掌握公式的使用和物质的结构以及性质是解题关键,难度不大.


科目:高中化学 来源: 题型:解答题
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 我国食盐有80%来自底下井盐和岩盐,用盐井水晒盐是制取食盐的常用方法.
我国食盐有80%来自底下井盐和岩盐,用盐井水晒盐是制取食盐的常用方法.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 验证烧碱溶液中是否含有Cl-,先加稀硝酸除去OH-,再加入AgNO3溶液,有白色沉淀,证明含Cl- | |
| B. | 某溶液中滴加BaCl2溶液,生成白色沉淀,证明一定含有SO42- | |
| C. | 某无色溶液滴入紫色石蕊试液显红色,该溶液一定显碱性 | |
| D. | 某固体中加入稀盐酸,产生了无色气体,证明该固体中一定含有碳酸盐或碳酸氢盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器编号 | 起始时各物质物质的量/mol | 达平衡时体系能量的变化 | ||
| X2 | Y2 | XY3 | ||
| ① | 1 | 3 | 0 | 放热46.3 kJ |
| ② | 0.8 | 2.4 | 0.4 | Q(Q>0) |
| A. | 容器①中达到平衡时,Y2的转化率为50% | |
| B. | Q=27.78kJ | |
| C. | 容器①、②中反应的平衡常数相等,K=$\frac{16}{27}$ | |
| D. | 相同温度下;起始时向容器中充入1.0X2mol、3.0molY2和2molXY3;反应达到平衡前v(正)>v(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
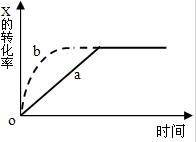 图中曲线a表示放热反应X(g)+Y(g)?Z(g)+N(s)进行过程中X的转化率随时间变化的关系,若只改变一个起始条件,使反应过程按b曲线进行,可采取的措施是( )
图中曲线a表示放热反应X(g)+Y(g)?Z(g)+N(s)进行过程中X的转化率随时间变化的关系,若只改变一个起始条件,使反应过程按b曲线进行,可采取的措施是( )| A. | 升高温度 | B. | 加大X的投入量 | C. | 使用催化剂 | D. | 缩小体积 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com