
| A. | 1.5mol/L | B. | 2.0mol/L | C. | 1mol/L | D. | 2.5mol/L |
分析 当碳酸钠滴入盐酸中时发生CO32-+2H+═H2O+CO2↑,当盐酸滴入碳酸钠溶液时,发生反应为CO32-+H+═HCO3-、HCO3-+H+═H2O+CO2↑,不管是将前者加入后者中,还是将后者加入前者中,都有气体产生,说明n(HCl):n(Na2CO3)>1:1,但最终产生的气体体积不同,说明n(HCl):n(Na2CO3)<2:1,根据二者之间的关系式来分析解答.
解答 解:当碳酸钠滴入盐酸中时发生CO32-+2H+═H2O+CO2↑,当盐酸滴入碳酸钠溶液时,反应顺序为CO32-+H+═HCO3-、HCO3-+H+═H2O+CO2↑,不管是将前者加入后者中,还是将后者加入前者中,都有气体产生,说明n(HCl):n(Na2CO3)>1:1,但最终产生的气体体积不同,说明n(HCl):n(Na2CO3)<2:1,
所以1<n(HCl):n(Na2CO3)<2,n(Na2CO3)=0.20mol,
则0.2mol<n(HCl)<0.4mol,盐酸的体积是200mL,所以$\frac{0.2mol}{0.2L}$<c(HCl)<$\frac{0.4mol}{0.2L}$,
即1mol/L<c(HCl)<2mol/L,
故选A.
点评 本题考查化学方程式的有关计算,明确二者滴定顺序不同其反应方程式不同是解本题关键,再根据题意结合反应方程式进行计算,注意碳酸钠和稀盐酸反应先后顺序,难度中等.


科目:高中化学 来源:2016-2017学年甘肃省高二上10月月考化学试卷(解析版) 题型:选择题
在水中加入下列物质 ,可使水的电离平衡正向移动的是( )
,可使水的电离平衡正向移动的是( )
A.NaOH B.NH4Cl C.NaCl D.H2SO4
查看答案和解析>>
科目:高中化学 来源:2017届重庆一中高三上学期第二次月考化学试卷(解析版) 题型:选择题
从海带中制取单质碘需要经过灼烧、溶解、过滤、氧化、萃取、分液、蒸馏等操作。下列图示对应的装置合理、操作规范的是
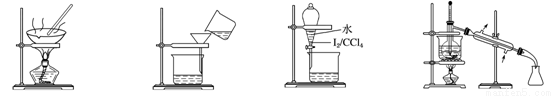
A.灼烧 B.过滤 C.分液 D.蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 化学键 | N≡N | H-O | O-O | H-N |
| E/kJ•mol-1 | a | b | c | d |
| 实验编号 | 温度 | 起始时物质的量/mol | 平衡时物质的量/mol | |
| N(SO2) | N(NO2) | N(NO) | ||
| 甲 | T1 | 0.80 | 0.20 | 0.18 |
| 乙 | T2 | 0.20 | 0.80 | 0.16 |
| 丙 | T3 | 0.20 | 0.30 | a |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
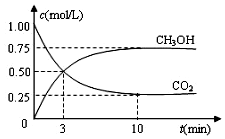 目前工业上可用CO2来生产燃料甲醇,有关反应为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.现向体积为1L的密闭容器中,充入1mol CO2和3mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示.
目前工业上可用CO2来生产燃料甲醇,有关反应为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.现向体积为1L的密闭容器中,充入1mol CO2和3mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2+ Na+ Cl- SO42- | B. | K+ Na+ CO32- NO3- | ||
| C. | K+ Na+ Cl- Cu2+ | D. | Na+Ba2+OH- SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com