
分析 (1)氯化铵是强酸弱碱盐,水解溶液呈酸性,铵根离子水解生成一水合氨和氢离子;
(2)醋酸根离子水解促进铵根离子水解,NH4HSO4 溶液中的氢离子抑制铵根离子的水解;
(3)混合溶液中氯离子浓度不变为0.1mol/L;依据溶液中氮元素的物料守恒计算得到;
(4)醋酸根离子水解程度和铵根离子水解程度相同,溶液呈中性,依据溶液中电荷守恒分析判断;
(5)①存在的分子有H2O、H2A,则H2A为弱酸;
②等体积混合生成Na2A,水解显碱性.
解答 解:(1)氯化铵是强酸弱碱盐,铵根离子水解显酸性;水解离子方程式为:NH4++H2O?NH3•H2O+H+;
故答案为:酸;NH4++H2O?NH3•H2O+H+;
(2)②0.1mol/L CH3COONH4 醋酸根离子水解促进铵根离子水解,铵根离子浓度小于0.1mol/L;③0.1mol/L NH4HSO4 溶液中的氢离子抑制铵根离子的水解,铵根离子浓度大于0.1mol/L,溶液呈酸性溶液②、③中c(NH4+)的大小关系是②<③,
故答案为:<;
(3)0.1mol/L NH3•H2O和0.1mol/L NH4Cl混合液中,氯离子浓度不变为0.1mol/L;根据氮元素守恒得到NH3•H2O和NH4+浓度为0.2mol/L;故答案为:Cl-;NH4+;
(4)常温下,测得溶液②的pH=7,说明0.1mol/L CH3COONH4 溶液中醋酸根离子和铵根离子水解程度相同;溶液中存在电荷守恒:[CH3COO-]+[OH-]=[NH4+]+[H+]PH=7说明溶液中[H+]=[OH-]得到:[CH3COO-]=[NH4+];
故答案为:=;=;
(5)①存在的分子有H2O、H2A,则H2A为弱酸,电离方程式为H2A?H++HA-、HA-?H++A2-,
故答案为:H2A?H++HA-、HA-?H++A2-;
(2)两溶液等体积混合生成Na2A,A2-水解显碱性,溶液的pH>7,
故答案为:>.
点评 本题考查了盐类水解的应用、离子浓度大小比较,题目难度中等,注意掌握盐的水解原理,明确弱电解质的电离平衡及其影响,能够根据电荷守恒、物料守恒及盐的水解原理判断溶液中各离子浓度大小.


 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 只有① | B. | 只有①② | C. | 除了③ | D. | 除了④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向碳酸氢铵溶液中加入过量的氢氧化钠溶液:HCO3-+OH-═CO32-+H2O | |
| B. | 钠投入水中:Na+H2O═Na++OH-+H2↑ | |
| C. | 将少量二氧化碳通入水玻璃中:CO2+SiO32-+H2O═CO32-+H2SiO3↓ | |
| D. | 氯气通入水中:Cl2+H2O═2H++Cl-+ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
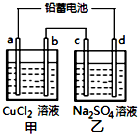 用铅蓄电池电解甲、乙电解池中的溶液.已知铅蓄电池的总反应为:
用铅蓄电池电解甲、乙电解池中的溶液.已知铅蓄电池的总反应为:| A. | d极为阴极 | |
| B. | 放电时铅蓄电池负极的电极反应式为:PbO2(s)+4H+(aq)+SO42-(aq)+4e-═PbSO4(s)+2H2O(l) | |
| C. | 若利用甲池精炼铜,b极应为粗铜 | |
| D. | 若四个电极材料均为石墨,当析出6.4gCu时,两池中共产生气体3.36L(标准状况下) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
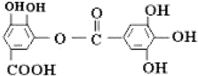
| A. | 常温下,能与NaHCO3溶液反应放出CO2 | |
| B. | 该有机物的分子式为C14H10O9 | |
| C. | 与稀H2SO4共热,生成2种有机物 | |
| D. | 能发生碱性水解反应,1mol该有机物完全反应消耗掉8molNaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
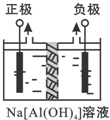 Al2O3、Al(OH)3都是重要化工原料.根据要求回答问题:
Al2O3、Al(OH)3都是重要化工原料.根据要求回答问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2、I2、HI平衡混合气体加压后颜色变深 | |
| B. | 夏天,打开冰镇啤酒瓶,立即冒出大量泡沫 | |
| C. | 生活中,用饱和碳酸钠溶液洗去锅碗瓢盆上的油污,且热溶液的效果更好 | |
| D. | 侯氏制碱工业中,降温析出副产品NH4Cl之前,向溶液中既撒NaCl固体又通入足量NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定含甲烷 | B. | 一定有乙烷 | ||
| C. | 一定是甲烷和乙烯的混合气体 | D. | 一定是甲烷和丙炔的混合气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com