
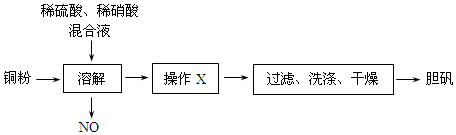
分析 (1)铜粉与稀硫酸、稀硝酸反应生成硫酸铜溶液,如得到胆矾,应将溶液进行蒸发浓缩、冷却结晶操作,然后经过滤、洗涤、干燥可得到晶体;过滤需要用到的玻璃仪器有漏斗、烧杯、玻璃棒;
(2)NO与空气、H2O反应生成硝酸,结合质量守恒平衡方程式.
(3)计算CuO、Cu的质量,结合铜元素质量守恒可计算CuSO4•5H2O的质量;结合反应的离子方程式计算原混合液中硫酸和硝酸的物质的量之比.
解答 解:(1)铜粉与稀硫酸、稀硝酸反应生成硫酸铜溶液,如得到胆矾,应将溶液进行蒸发浓缩、冷却结晶操作,然后经过滤、洗涤、干燥可得到晶体;过滤需要用到的玻璃仪器有漏斗、烧杯、玻璃棒;
故答案为:蒸发浓缩、冷却结晶;漏斗、烧杯、玻璃棒;
(2)NO与空气、H2O反应生成硝酸,反应的方程式为4NO+3O2+2H2O=4HNO3;
故答案为:4NO+3O2+2H2O=4HNO3;
(3)①n(CuO)=48g×20%÷80g/mol=0.12mol,n(Cu)=48g×(1-20%)÷64g/mol=0.6mol,则n(CuSO4•5H2O)=0.12mol+0.6mol=0.72mol,m(CuSO4•5H2O)=0.72mol×250g/mol=180g;
故答案为:180 g;
②发生反应:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
n(HNO3)=$\frac{0.6mol}{3}×2$=0.4mol,n(H2SO4)=n(CuSO4•5H2O)=0.72mol,
则n(H2SO4):n(HNO3)=0.72mol:0.4mol=9:5;
故答案为:9:5.
点评 本题考查物质的分离、提纯的实验综合应用,为高频考点,侧重于学生的分析能力、实验能力和计算能力的考查,主要把握实验的原理、操作方法以及守恒法应用于化学方程式的计算,难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 在镀件上电镀铜时,可用金属铜作阳极 | |
| B. | 镀层破损后,白铁(镀锌)比马口铁(镀锡)更易被腐蚀 | |
| C. | 工业上电解饱和食盐水制烧碱,NaOH在阴极产生 | |
| D. | 钢铁在发生析氢腐蚀和吸氧腐蚀时,完全相同的反应是负极反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.12 g | B. | 4.24 g | C. | 3.18 g | D. | 5.28 g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
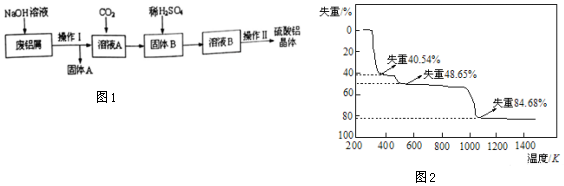
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 每当固体质量减轻5.6g时,生成2.8g Si | |
| B. | 氧化剂和还原剂的物质的量之比为1:2 | |
| C. | 硅单质在常温下不与任何酸、碱反应 | |
| D. | 单质硅与单质碳均具有一定的还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
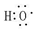 ;
; 查看答案和解析>>
科目:高中化学 来源: 题型:解答题
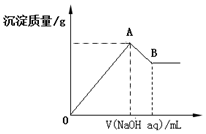 在含有0.60molCl-、0.80molSO42-及一定量Mg2+和Al3+的混合溶液中,滴入一定浓度NaOH溶液,产生沉淀情况如图(不考虑Mg2+和Al3+水解及水电离对离子数目的影响).若反应前Al3+的物质的量为a mol,Al3+的物质的量与混合溶液中离子总物质的量的比值为x.
在含有0.60molCl-、0.80molSO42-及一定量Mg2+和Al3+的混合溶液中,滴入一定浓度NaOH溶液,产生沉淀情况如图(不考虑Mg2+和Al3+水解及水电离对离子数目的影响).若反应前Al3+的物质的量为a mol,Al3+的物质的量与混合溶液中离子总物质的量的比值为x.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{\;}^{1}$H(氕)、${\;}_{\;}^{2}$H(氘)、${\;}_{\;}^{3}$H(氚)是三种氢元素 | |
| B. | 所有氢元素粒子的核外都只有一个电子 | |
| C. | 所有氢元素粒子的化学性质都相同 | |
| D. | 能用符号H表示的原子在元素周期表中的位置相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯和甲烷都能发生加成反应 | |
| B. | 米酒变酸是因为乙醇被氧化为乙酸 | |
| C. | 糖类、油脂、蛋白质都属于天然高分子化合物 | |
| D. | 可用热的NaOH溶液除去乙酸乙酯中的乙酸杂质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com