
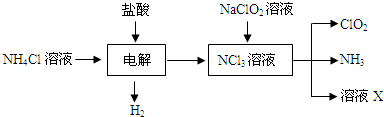

���� ���������̿�֪�Ȼ����������Һ�н��е�⣬����������������������NCl3����ⷽ��ʽΪNH4Cl+2HCl$\frac{\underline{\;���\;}}{\;}$NCl3+3H2������NCl3��Һ�м���NaClO2��������ClO2��NH3��X��
��1���ɹ�������ת����ϵ��֪������Ȼ������������Һ������NCl3��H2��
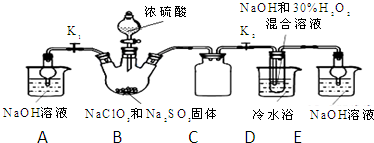
��2������Ϣ��֪��ClO2������ˮ�����Բ�������ˮ��Һ���գ�����Ϊ�������壬�ݴ��жϣ�
��3��������Ŀ��Ϣ��֪��ClO2ͨ����ƿ�����Ե⻯����Һ��Ӧ������I-ΪI2����������ԭΪCl-��ͬʱ����ˮ��
����ˮ�ٴ����ղ���Ķ����������壬��ʹ��ƿ����ѹǿ��ȣ�
�۵���������Һ����ɫ��
�ܸ��ݹ�ϵʽ2ClO2��5I2��10Na2S2O3����n��ClO2�����ٸ���m=nM����m��ClO2����
��� �⣺��1������Ȼ�狀���������Һʱ����������ͼ֪������������NCl3�����ⷴӦ����ʽΪ��NH4Cl+2HCl$\frac{\underline{\;���\;}}{\;}$3H2��+NCl3��
�ʴ�Ϊ��NH4Cl+2HCl$\frac{\underline{\;���\;}}{\;}$3H2��+NCl3��
��2��A��ClO2������ˮ���������ñ���ʳ��ˮ���հ�������A����
B����ʯ�Ҳ������հ�������B����
C��Ũ����������հ������Ҳ�Ӱ��ClO2����C��ȷ��
D��ClO2������ˮ����������ˮ���հ�������D����
�ʴ�Ϊ��C��
��3��������Ŀ��Ϣ��֪��ClO2ͨ����ƿ�����Ե⻯����Һ��Ӧ������I-ΪI2����������ԭΪCl-��ͬʱ����ˮ����Ӧ���ӷ���ʽΪ2ClO2+10I-+8H+=2Cl-+5I2+4H2O��
�ʴ�Ϊ��2ClO2+10I-+8H+=2Cl-+5I2+4H2O��
��װ���в���Һ��ܵ������ǣ���ˮ�ٴ����ղ���Ķ����������壬��ʹ��ƿ����ѹǿ��ȣ�
�ʴ�Ϊ�����ղ���Ķ����������壬��ʹ��ƿ����ѹǿ��ȣ�
�۵���������Һ����ɫ�����ζ��յ�ʱ����ȫ��Ӧ�������յ������ǣ���Һ����ɫǡ�ñ�Ϊ��ɫ���Ұ�����ڲ���ɫ��
�ʴ�Ϊ����Һ����ɫǡ�ñ�Ϊ��ɫ���Ұ�����ڲ���ɫ��
��VmLNa2S2O3��Һ����Na2S2O3���ʵ���ΪV•10-3 L��cmol/L=c•V•10-3 mol����
���ݹ�ϵʽ��2ClO2��5I2��10Na2S2O3��
2 10
n��ClO2�� c•V•10-3 mol
����n��ClO2��=$\frac{1}{5}$c•V•10-3 mol��
����m��ClO2��=$\frac{1}{5}$c•V•10-3 mol��67.5g/mol=1.35cv��10-2g��
�ʴ�Ϊ��1.35cV��10-2g��
���� �������ȼ��仯��������ʿ���������ԭ��Ӧ�����ʵ��Ʊ�ʵ�飬����ϰ���е���Ϣ��֪ʶǨ��Ӧ��Ϊ���Ĺؼ�������ѧ���ۺ�Ӧ����������Ϣ��ȡ�ͷ��������Ŀ��飬��Ŀ�ѶȽϴ�


 �ܿ�����ĩ��̾�ϵ�д�
�ܿ�����ĩ��̾�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | PM2.5��ʾÿ����������ֱ��С�ڻ����2.5�Ŀ�����ĺ�����PM2.5ֵԽ�ߣ�������ȾԽ���أ������PM2.5���������һ���������ܽ� | |
| B�� | ��¼Ƭ����ϸ������ú�Ĵ���ȼ���Dz�����������Ҫԭ�����ʹ��ǰ��ú�������������ɼ��ٶ���������ŷţ�ʯ�෨��������һ�ֳ��õ������� | |
| C�� | ����β���еĵ��������̼�⻯�����ڴ�����������ǿ�ҵ�̫����������������һ���µĶ�����Ⱦ��--�⻯ѧ����Ҳ����������������β���к��е������ԭ��������ȼ�ղ���� | |
| D�� | ��ֲ�����֣�ʹ�á��Ҵ����͡�����ȼúΪȼ�������ʱʹ��PM2.5�Ŀ��ֵȶ������������������ֺ�����������Ч��ʩ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
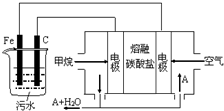 �縡ѡ���۷��ǹ�ҵ�ϲ��õ�һ����ˮ����������������ˮ��pH��5.0��6.0֮�䣬ͨ���������Fe��OH��3������Fe��OH��3�������ԣ�������������������������о���ˮ�����ã��������������ݰ���ˮ�����������ˮ���γɸ����㣬��ȥ����Ʋ���������㣬�����˸�ѡ���������ã�ij����С���õ縡ѡ���۷�������ˮ�����װ��ʾ��ͼ����ͼ��ʾ������˵����ȷ���ǣ�������
�縡ѡ���۷��ǹ�ҵ�ϲ��õ�һ����ˮ����������������ˮ��pH��5.0��6.0֮�䣬ͨ���������Fe��OH��3������Fe��OH��3�������ԣ�������������������������о���ˮ�����ã��������������ݰ���ˮ�����������ˮ���γɸ����㣬��ȥ����Ʋ���������㣬�����˸�ѡ���������ã�ij����С���õ縡ѡ���۷�������ˮ�����װ��ʾ��ͼ����ͼ��ʾ������˵����ȷ���ǣ�������| A�� | ��ȼ�ϵ����������̼����Ϊ����ʣ�CH4Ϊȼ�ϣ�����Ϊ�����������ĵ缫��Ӧ��CH4+4CO32--8e-�T5CO2+2H2O | |
| B�� | ʵ��ʱ����ˮ������Ũ�Ƚ�С�����������ϲ�����������ʻ�������ʹ�������γɸ�������ʱ����������ˮ�м���������ϡH2SO4 | |
| C�� | ʵ������У�����������2mol���壬��ȼ�ϵ������11.2L CH4 | |
| D�� | Ϊ��ʹ�õ�س�ʱ���ȶ����У���صĵ�������Ӧ�����ȶ�����ع���ʱ�����в���A�μ�ѭ������A������CO32- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
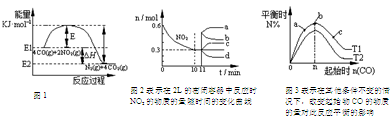
| A�� | ��һ���¶ȡ��̶��ݻ����ܱ���������������ܶȲ��ٸı����˵���������淴Ӧ�Ѵ�ƽ�� | |
| B�� | ��ͼ1�ɵü����ʵ��Ĵ�����E��С����H ���� | |
| C�� | ͼ3��T1��T2��ʾ�¶ȣ���Ӧ�¶��µ�ƽ�ⳣ��ΪK1��K2����T1��T2��K1��K2 | |
| D�� | ͼ2��0��10min�ڸ÷�Ӧ��ƽ������v��CO��=0.03mol•L-1•min-1����11min�������������䣬ѹ�����������Ϊ1L����n��NO2���ı仯����Ϊd |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
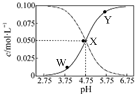 25��ʱ����c��CH3COOH��+c��CH3COO-��=0.1mol•L-1��һ����ᡢ�����ƻ����Һ����Һ��c��CH3COOH����c��CH3COO-����pH �Ĺ�ϵ��ͼ��ʾ�������й���Һ������Ũ�ȹ�ϵ��������ȷ���ǣ�������
25��ʱ����c��CH3COOH��+c��CH3COO-��=0.1mol•L-1��һ����ᡢ�����ƻ����Һ����Һ��c��CH3COOH����c��CH3COO-����pH �Ĺ�ϵ��ͼ��ʾ�������й���Һ������Ũ�ȹ�ϵ��������ȷ���ǣ�������| A�� | Y������ʾ����Һ�У�c��CH3COO-����c��CH3COOH����c��H+����c��OH-�� | |
| B�� | W������ʾ����Һ�У�c��Na+��+c��H+��+c��OH-��+c��CH3COOH��=0.1mol•L-1 | |
| C�� | ���¶��´���ĵ���ƽ�ⳣ��Ϊ10-1 mol•L-1 | |
| D�� | ��X������ʾ����Һ�м���������0.05 mol•L-1 NaOH��Һ��c��H+��=c��CH3COOH��+c��OH-�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 2.1g | B�� | 3.6g | C�� | 5.7g | D�� | 37.7g |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com