
| A. | 只能为2 | B. | 只能为3 | ||
| C. | 可能为2,也可能为3 | D. | 无法确定 |
分析 恒温恒容下,开始充入4molA和2molB与开始充入1.2molA、0.6molB和2.8molX达到平衡后,X的体积分数为Ω%,说明为完全等效平衡,按化学计量数转化到左边,满足n(A)=4mol、n(B)=2mol,据此解答.
解答 解:恒温恒容下,开始充入4molA和2molB与开始充入1.2molA、0.6molB和2.8molX达到平衡后,X的体积分数为Ω%,说明为完全等效平衡,按化学计量数转化到左边,满足n(A)=4mol、n(B)=2mol,故1.2mol+$\frac{2.8}{x}$×2=4mol,解得x=2,但是对于反应前后气体系数和相等的反应,物质的投料比等于化学计量数之比,也是等效平衡,所以x=3也是正确的.
故选C.
点评 本题考查化学平衡计算、等效平衡等,难度中等,恒温恒容,反应前后气体体积不等,按化学计量数转化一边,对应物质满足等量;反应前后气体体积相等,按化学计量数转化一边,对应物质满足等比.


科目:高中化学 来源: 题型:解答题

 ,若D最外层只有两个电子,则D的原子结构示意图
,若D最外层只有两个电子,则D的原子结构示意图 ;
;
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | +5+3-3 | -2 |
| A. | X.Y元素的金属性:X<Y | |
| B. | 一定条件下,Z单质与W的常见单质直接生成ZW2 | |
| C. | Y的最高价氧化物的水化物能溶于稀氨水 | |
| D. | Z的最高价氧化物的水化物是强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
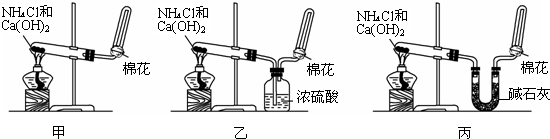
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2通入石蕊溶液中,溶液变红 | |
| B. | 铁粉与高温水蒸气反应时,固体逐渐变黑 | |
| C. | 将一定量草酸溶液与高锰酸钾溶液混合静置,观察发现溶液褪色速率逐渐变慢 | |
| D. | 将少量CuSO4固体加入无水乙醇中,振荡后静置,上层清液即为CuSO4胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaAlO2(aq)$\stackrel{过量盐酸}{→}$AlCl3$\stackrel{NaOH溶液}{→}$Al2O3 | |
| B. | N2$→_{△}^{O_{2}/催化剂}$NO2$\stackrel{O_{2}、H_{2}O}{→}$HNO3 | |
| C. | NaCl(饱和)$\stackrel{NH_{3}、CO_{2}}{→}$NaHCO3$\stackrel{△}{→}$Na2CO3 | |
| D. | FeS2$\stackrel{煅烧}{→}$SO3$\stackrel{H_{2}O}{→}$H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
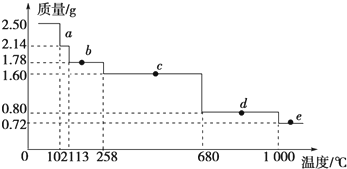
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用CO2鉴别NaAlO2溶液和CH3COONa溶液 | |
| B. | 用湿润的碘化钾淀粉试纸鉴别Br2(g)和NO2 | |
| C. | 用KOH溶液鉴别SO3(g)和SO2 | |
| D. | 用BaCl2溶液鉴别AgNO3溶液和K2SO4溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com