
| A. | 加入水时,平衡向右移动,CH3COOH电离常数增大 | |
| B. | 加入少量CH3COONa固体,平衡向右移动 | |
| C. | 加入少量NaOH固体,平衡向右移动,c(H+)减小 | |
| D. | 加入少量pH=5的硫酸,溶液中c(H+)增大 |
分析 A.温度不变,电离平衡常数不变;
B.加入少量CH3COONa固体,由电离平衡可知c(CH3COO-)增大,则电离平衡逆向移动误;
C.加入少量NaOH固体,与溶液中的H+结合,导致溶液中氢离子浓度减小;
D.pH=5的CH3COOH溶液中,氢离子浓度为1×10-5mol•L-1,加入少量pH=5的硫酸,该硫酸溶液中氢离子浓度为1×10-5mol•L-1,氢离子浓度相等,平衡不移动.
解答 解:A.加水促进弱电解质的电离,则电离平衡正向移动,由于温度不变,则醋酸的电离平衡常数不会变化,故A错误;
B.加入少量CH3COONa固体,c(CH3COO-)增大,该电离电离平衡向左移动,故B错误;
C.加入少量NaOH固体,氢氧化钠电离的氢氧根离子与CH3COOH电离生成的H+反应生成水,导致溶液中氢离子浓度减小,故C正确;
D.pH=5的CH3COOH溶液中,氢离子浓度为1×10-5mol•L-1,pH=5的硫酸溶液中氢离子浓度为1×10-5mol•L-1,两溶液中氢离子浓度相等,平衡不移动,则混合液中c(H+)不变,故D错误;
故选C.
点评 本题考查了电离平衡及其影响,题目难度中等,明确电离平衡及其影响因素为解答关键,D为易错点,注意氢离子浓度相同,电离平衡不移动,试题培养了学生的分析能力及灵活应用能力.


 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:选择题
| 现象或事实 | 解释 | |
| A | 进行中和热测定时,将NaOH溶液一次性快速倒入盛有H2SO4的量热计中 | 减少热量散失,减少测量误差 |
| B | 加热滴有酚酞试剂的纯碱溶液,溶液红色变深 | 加热促进水的电离,溶液的碱性增强 |
| C | 电解AlCl3水溶液,阴极周围出现白色胶状沉淀 | 生产的Al(OH)3胶体粒子带正电荷,发生定向移动 |
| D | 用FeCl3溶液制作印刷线路板 | FeCl3能从含有Cu2+的溶液中置换出Cu |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业生产硫酸的过程中使用过量的空气,以提高二氧化硫的转化率 | |
| B. | 氯化镁溶液加热蒸干最终得不到氯化镁固体 | |
| C. | 实验室用排饱和食盐水的方法手机氯气 | |
| D. | 合成氨是放热反应,采用在较高温度下进行反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

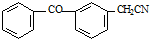 由C→D的反应类型是取代反应
由C→D的反应类型是取代反应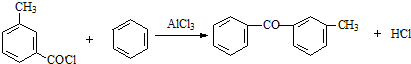

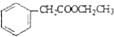 的合成路线流程图(无机试剂可任选).合成路线流程图示例如图:H2C═CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH
的合成路线流程图(无机试剂可任选).合成路线流程图示例如图:H2C═CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH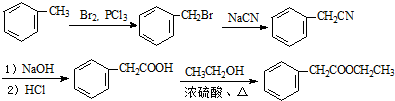 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HNO3、NaOH、BaSO4均属于电解质 | |
| B. | SO2、NO2、CO2均能形成酸雨 | |
| C. | NH4HCO3、NH4Cl、I2受热后均无固体剩余 | |
| D. | FeCl2、NaHSO3、Fe(OH)3均能通过化合反应直接制得 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| B. | 饱和Na2CO3溶液中通入足量CO2:2Na++CO32-+CO2+H2O═2NaHCO3↓ | |
| C. | 酸性溶液中KIO3与KI反应生成I2:IO3-+5I-+6H+═3I2+3H2O | |
| D. | 漂白粉溶液中加入醋酸:CH3COOH+ClO-═HClO+CH3COO- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 离子符号 | Fe3+ | Fe2+ | Cu2+ |
| 氢氧化物开始沉淀时的pH | 2.5 | 7.0 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 9.7 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com