
(14分)Ⅰ、已知:C(s)+H2O(g) CO(g)+H2(g); ΔH一定温度下,在1.0 L密闭容器中放入1 mol C(s)、1 mol H2O(g)进行反应,反应时间(t)与容器内气体总压强(p)的数据见下表:
CO(g)+H2(g); ΔH一定温度下,在1.0 L密闭容器中放入1 mol C(s)、1 mol H2O(g)进行反应,反应时间(t)与容器内气体总压强(p)的数据见下表:
时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
总压强p/100 kPa | 4.56 | 5.14 | 5.87 | 6.30 | 7.24 | 8.16 | 8.18 | 8.20 | 8.20 |
回答下列问题:
(1)下列哪些选项可以说明该可逆反应已达平衡状态 。
A.混合气体的密度不再发生改变
B.消耗1 mol H2O(g)的同时生成1 mol H2
C.混合气体的总体积
D.v正(CO) = v逆(H2)
(2)由总压强P和起始压强P0表示反应体系的总物质的量n总,n总= mol;
Ⅱ、根据最新“人工固氮”的报道,在常温、常压、光照条件下,N2在催化剂表面可与水发生反应生成NH3,反应方程式:2N2(g)+ 6H2O(l) 4NH3(g)+ 3O2(g),进一步研究生成量与温度的关系,常压下测得部分数据如下表:
4NH3(g)+ 3O2(g),进一步研究生成量与温度的关系,常压下测得部分数据如下表:

(1)该反应的△H_____O, △S____0(填“>,<,=”)
(2)该反应在30℃、40℃时化学平衡常数分别为K1、K2,则K1_______K2(选填“>,<,=”)
(3)与目前广泛应用的工业合氨相比,该方法的固氮速率慢,氨的生成浓度低,有人提出在常压、450℃下进行该反应,效率将更高,科学家认为该方案不可行,理由是__________.
Ⅲ、向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量。其中H2S、HS?、S2?的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如图所示(忽略滴加过程H2S气体的逸出)。

试分析:
①B曲线代表 (用微粒符号表示)分数变化;滴加过程中,溶液中一定成立:c(Na+)= 。
②M点,溶液中主要涉及的离子方程式: 。
I、(1)AD ; (2)P/P0
II、(1)>, > (2)<
(3)在常压、450℃条件下,水处于气态,该反应的△H>0, △S<0,所以该反应不能自发进行
Ⅲ、(1)HS- ; c(Na+)=3[c(H2S)+c(HS-)+c(S2-)](由物料守恒得出)
或c(Na+)= c(Cl-)+c(OH-)+c(HS-)+2c(S2-)-c(H+)(由电荷守恒得出)
(2)M点:2S2-+3H+=HS-+H2S(分两步写也可)
【解析】
试题分析:Ⅰ、(1)C(s)+H2O(g) CO(g)+H2(g)在1.0 L密闭容器中放入1 mol C(s)、1 mol H2O(g)进行反应,反应过程中气体总质量不断增大,故密度不断增大,当混合气体密度不再发生改变,则反应达到平衡状态,A项正确;反应过程中消耗1 mol H2O(g)的同时生成1 mol H2,B项错误;恒容,故混和气体总体积不变,C项错误;v正(CO) = v逆(H2)则说明正逆反应速率相等,反应达到平衡状态,故D项正确;(2)同温、同体积压强之比等于物质的量之比,故n(总)= P/P0×1mol= P/P0mol;Ⅱ、(1)2N2(g)+ 6H2O(l)
CO(g)+H2(g)在1.0 L密闭容器中放入1 mol C(s)、1 mol H2O(g)进行反应,反应过程中气体总质量不断增大,故密度不断增大,当混合气体密度不再发生改变,则反应达到平衡状态,A项正确;反应过程中消耗1 mol H2O(g)的同时生成1 mol H2,B项错误;恒容,故混和气体总体积不变,C项错误;v正(CO) = v逆(H2)则说明正逆反应速率相等,反应达到平衡状态,故D项正确;(2)同温、同体积压强之比等于物质的量之比,故n(总)= P/P0×1mol= P/P0mol;Ⅱ、(1)2N2(g)+ 6H2O(l)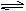 4NH3(g)+ 3O2(g),反应,由表中所给NH3的平衡浓度与温度关系可知升高温度NH3的平衡浓度增大,故平衡正向移动,则该反应吸热,△H>0;该反应正向气体量增多,故△S>0;(2) 该反应在30℃、40℃时化学平衡常数分别为K1、K2,则K1< K2;(3)在常压、450℃条件下,水处于气态,该反应的△H>0, △S<0,所以该反应不能自发进行,故该反应不可采用常压、450℃;Ⅲ、向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量,发生反应为:①H++ OH—=H2O、②S—+ H+=HS-、③HS-+ H+= H2S,故曲线B代表HS-变化;滴加过程中物料守恒:2 c(Na+)=3[c(H2S)+c(HS-)+c(S2-)],或电荷守恒:c(Na+)+ c(H+)= c(Cl-)+c(OH-)+c(HS-)+2c(S2-);M点溶液溶质为:NaCl、NaHS、H2S,故溶液中主要涉及的离子方程式S—+ H+=HS-、HS-+ H+= H2S(或2S2-+3H+=HS-+H2S)。
4NH3(g)+ 3O2(g),反应,由表中所给NH3的平衡浓度与温度关系可知升高温度NH3的平衡浓度增大,故平衡正向移动,则该反应吸热,△H>0;该反应正向气体量增多,故△S>0;(2) 该反应在30℃、40℃时化学平衡常数分别为K1、K2,则K1< K2;(3)在常压、450℃条件下,水处于气态,该反应的△H>0, △S<0,所以该反应不能自发进行,故该反应不可采用常压、450℃;Ⅲ、向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量,发生反应为:①H++ OH—=H2O、②S—+ H+=HS-、③HS-+ H+= H2S,故曲线B代表HS-变化;滴加过程中物料守恒:2 c(Na+)=3[c(H2S)+c(HS-)+c(S2-)],或电荷守恒:c(Na+)+ c(H+)= c(Cl-)+c(OH-)+c(HS-)+2c(S2-);M点溶液溶质为:NaCl、NaHS、H2S,故溶液中主要涉及的离子方程式S—+ H+=HS-、HS-+ H+= H2S(或2S2-+3H+=HS-+H2S)。
考点:化学反应原理及图像问题。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014-2015学年山东省高三元月模拟测试化学试卷(解析版) 题型:选择题
短周期元素X、Y、Z、W 的原子序数依次增大,且原子最外层电子数之和为13,X 的原子半径比Y 的小,X 与W 同主族,Z 是地壳中含量最高的元素。下列说法正确的是
A.由X 、Y组成的化合物的沸点总低于由X与Z组成的化合物的沸点
B.元素Z、W 的简单离子的电子层结构不同
C.元素Y 的简单气态氢化物的热稳定性比Z 的强
D.只含X、Y、Z 三种元素的化合物,可能是离子化合物,也可能是共价化合物
查看答案和解析>>
科目:高中化学 来源:2014--2015吉林省高一上学期期末化学试卷(解析版) 题型:选择题
下列实验操作:①取液体试剂,②取固体试剂,③溶解,④过滤,⑤蒸发。一定要用到玻璃棒的是
A.①②③ B.②③④ C.①②⑤ D.③④⑤
查看答案和解析>>
科目:高中化学 来源:2014-2015浙江省高一1月月考化学试卷(解析版) 题型:选择题
下列有关NaHCO3和Na2CO3性质的比较中,正确的是
A.热稳定性:Na2CO3<NaHCO3
B.常温时在水中的溶解度:Na2CO3<NaHCO3
C.等质量的NaHCO3和Na2CO3与足量稀盐酸反应产生CO2的量:Na2CO3<NaHCO3
D.等物质的量的NaHCO3和Na2CO3与足量稀盐酸反应,NaHCO3放出的CO2多
查看答案和解析>>
科目:高中化学 来源:2014-2015浙江省高一1月月考化学试卷(解析版) 题型:选择题
下列溶液中的氯离子浓度与50 mL 1 mol·L-1的AlCl3溶液中氯离子浓度相等的是
A.150 mL 3 mol·L-1的KClO3
B.75 mL 2 mol·L-1的NH4Cl
C.150 mL 2 mol·L-1的CaCl2
D.350 mL 3 mol·L-1的NaCl
查看答案和解析>>
科目:高中化学 来源:2014-2015浙江省高二1月月考化学试卷(解析版) 题型:选择题
在下列给定条件的溶液中,一定能大量共存的离子组是
A.无色溶液:Ca2+、H+、Cl-、HSO3-
B.能使pH试纸呈红色的溶液:Na+、NH+4、I-、NO3-
C.NaHCO3溶液:K+、Fe3+、SO42-、NO3-
D.Kw/c(H+)=0.1 mol/L的溶液:Na+、K+、SiO32-、NO3-
查看答案和解析>>
科目:高中化学 来源:2014-2015浙江省高二1月月考化学试卷(解析版) 题型:选择题
下列事实不能用勒夏特列原理解释的是
A.开启啤酒瓶后,瓶中立刻泛起大量泡沫
B.由H2、I2蒸气、HI组成的平衡体系加压后颜色变深
C.向氯水中加少量NaHCO3固体后,溶液的漂白性增强
D.在含有[Fe(SCN)3]的红色溶液中加铁粉,振荡静置,溶液颜色变浅或褪去
查看答案和解析>>
科目:高中化学 来源:2014-2015山东省淄博市高二12月月考化学试卷(解析版) 题型:选择题
实验室用标准盐酸溶液测定某NaOH溶液的浓度,用甲基橙作指示剂,下列操作中可能使测定结果偏低的是
A.酸式滴定管在装酸液前未用标准盐酸溶液润洗2~3次
B.开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失
C.锥形瓶内溶液颜色变化由黄色变橙色,立即记下滴定管液面所在刻度
D.盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2~3次
查看答案和解析>>
科目:高中化学 来源:2014-2015江西省高二上学期期中考试化学试卷(解析版) 题型:填空题
(10分)某温度下,水的离子积Kw=l×10-13。有酸溶液A,pH=a;碱溶液B,pH=b。为测定A、B混合后溶液导电性的变化以及探究A、B的相关性质,某同学设计了如图所示的实验装置。

(1)实验时,烧杯中应盛 (选A或B)溶液。
(2)若A为一元强酸,B为一元强碱,且a+b=13。该同学在烧杯中先加入其中一种溶液,闭合开关K,测得烧杯中灯泡的亮度为10(假设亮度由暗到亮表示为1、2、3、…10、11、12、… 20)。断开开关K,将滴定管中的溶液逐滴加入到烧杯中。当从滴定管滴入烧杯中的溶液体积和烧杯中盛有的溶液体积相等时,停止滴加溶液并闭合开关K,此时灯泡G的亮度约为 ,原因是 。烧杯中得到的溶液pH= 。
(3)若A为强酸,B为强碱,且a+b=13。断开开关K,将滴定管中的溶液逐滴加入到烧杯中。当测得烧杯中溶液pH和“(2)”中最后得到的溶液pH相同时,停止滴加溶液。此时烧杯中的溶液中阳离子浓度大于阴离子浓度,原因可能是 。
(4)若A的化学式为HR,B的化学式为MOH,且a+b=13,两者等体积混合后溶液显碱性。则混合溶液中必定有一种离子能发生水解,该水解反应的离子方程式为____ ____。
此时烧杯中的混合溶液中,微粒浓度大小关系一定正确的是___ ___(填序号)。
①c(MOH)>c(M+)>C(R-)>c(H+)>c(OH-)
②c(HR)>c(M+)>c(R-)>c(OH-)>c(H+)
③c(R-)>c(M+)>c(H+)>c(OH-)
④c(M+)>c(R-)>c(OH-)>c(H+)
⑤c(M+)+ c(H+)=c(R-)+c(OH-)
⑥c(MOH)=c(H+)-c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com