
【题目】将质量分数分别为7a%和3a%的两种硫酸溶液等体积混合,则所得溶液中溶质的质量分数
A. 等于5a%B. 小于5a%C. 大于5a%D. 无法确定
科目:高中化学 来源: 题型:
【题目】在1、3、5号试管中分别加入2 mL蒸馏水,2、4、6号试管中分别加入2 mL发芽的小麦种子匀浆样液,然后在1~4号试管中适量滴加斐林试剂,5、6号试管中合理滴加双缩脲试剂,摇匀。预期观察到的实验现象是

A. 1、3、5号试管内都呈蓝色
B. 3组实验中甲组和乙组的实验结果相同
C. 4号试管内呈砖红色,其余试管内都呈蓝色
D. 4号试管内呈砖红色,5号试管内呈紫色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NH4HCO3![]() NH3↑+CO2↑+H2O↑。为了将混有硫酸钠、碳酸氢铵的NaCl提纯,并制得纯净的NaCl溶液,某学生设计如下实验方案:
NH3↑+CO2↑+H2O↑。为了将混有硫酸钠、碳酸氢铵的NaCl提纯,并制得纯净的NaCl溶液,某学生设计如下实验方案:

(1)操作④中所需的玻璃仪器有__________________。
(2)操作②为什么不用硝酸钡溶液,其理由是__________。
(3)进行操作②后,如何判断SO42-已除尽,方法是______
(4)操作③的目的是__________,其相应的化学方程式为:_____;为什么不先过滤,后加碳酸钠溶液,其理由是_______。
(5)说明此设计方案不严密之处及正确的方法____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知甲为恒压容器、乙为恒容容器。相同条件下充入等物质的量NO2气体,且起始时体积相同。发生反应:2NO2(g)![]() N2O4(g) △H<0。一段时间后均达到平衡状态。下列说法中正确的是
N2O4(g) △H<0。一段时间后均达到平衡状态。下列说法中正确的是
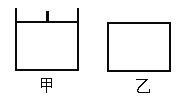
A. 平衡时NO2体积分数:甲<乙
B. 达到平衡所需时间,甲与乙相等
C. 该反应的平衡常数表达式K=c(N2O4)/c(NO2)
D. 若两容器内气体的压强保持不变,均说明反应已达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由CO2、CO、H2组成的混合气体在同温同压下与氮气的密度相同,则该混合气体中CO2、H2、CO的体积比可为( )
A. 13∶8∶29B. 22∶1∶14
C. 29∶8∶13D. 13∶16∶57
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g) + 5O2(g) ![]() 4NO(g) + 6H2O(g),下列叙述正确的是
4NO(g) + 6H2O(g),下列叙述正确的是
A. 化学反应速率关系是:2v正(NH3) = 3v正(H2O)
B. .若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C. 达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D. 达到化学平衡时,4v正(O2) = 5v逆(NO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数,下列叙述中正确的是( )
A. 常温常压下,11.2LCO2所含的原子数为1.5NA
B. 常温常压下,48gO3所含的原子数为3NA
C. 标准状况下,22.4LH2O所含的分子数为NA
D. 22.4LH2所含的原子数为2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com