
【题目】实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。现有一定量的铁铝合金与很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液x中,逐滴加入4molL﹣1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。则下列有关计算和判断正确的是( )
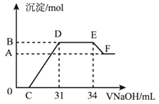
A.溶液x中所含的阳离子有:Al3+、H+、Fe3+、Fe2+
B.在DE段,发生反应的离子方程式为NH4++OH﹣→NH3H2O
C.无法求出B点对应的沉淀的物质的量
D.C点对应的氢氧化钠溶液的体积为7mL
【答案】BD
【解析】
铝粉和铁粉的混合物与一定量很稀HNO3充分反应,被氧化为Al3+、Fe3+,通过题意,反应始终没有气体生成,可以得出不会有氮的氧化物生成,又有硝酸的浓度越稀,对应还原产物中氮元素的化合价越低,可以推测N元素由+5变成了﹣3价,由图可得硝酸过量,加入氢氧化钠溶液应先与硝酸反应,再生成沉淀,当沉淀完全后,由图知继续加入氢氧化钠溶液,沉淀量不变,可得与NH4+发生了反应,则随着NaOH的滴加,发生的反应依次有:
①H++OH﹣=H2O,
②Fe3++3OH﹣=Fe(OH)3↓,Al3++3OH﹣=Al(OH)3↓,
③NH4++OH﹣═NH3H2O,
④Al(OH)3+OH﹣=AlO2﹣+2H2O,据此分析解答。
A.根据图示得到的溶液和氢氧化钠反应产生沉淀的情况可以知道,金属铁和稀硝酸反应生成硝酸铁、硝酸铵和水,反应的离子方程式为:8Fe+30H++3NO3﹣=8Fe3++3NH4++9H2O,金属铝和硝酸反应生成硝酸铝、硝酸铵和水,溶液x中所含的阳离子有:Al3+、H+、Fe3+、NH4+,硝酸过量,不可能生成亚铁离子,故A错误;
B.DE一段沉淀的量没有发生变化,为NH4NO3和NaOH反应,反应的离子方程式为NH4++OH﹣═NH3H2O,故B正确;
C.图中OC段没有沉淀生成,此阶段发生的离子方程式为H++OH﹣=H2O;在DE段沉淀的物质的量没有变化,应为NH4+和OH﹣的反应,此阶段发生反应的离子方程式为NH4++OH﹣═NH3H2O;根据NH4++OH﹣═NH3H2O 得:n(NH4+)=(34﹣31)×10﹣3L×4mol/L=0.012 mol,根据氧化还原反应,N元素由+5价变为﹣3价,而金属都由0价变为+3价,可以运用电子守恒得出金属的物质的量为:![]() =0.032mol,所以生成沉淀的物质的量为0.032mol,故C错误;
=0.032mol,所以生成沉淀的物质的量为0.032mol,故C错误;
D.金属的物质的量为0.032mol,根据金属离子带3个正电荷分析,铝离子和铁离子生成沉淀需要的氢氧化钠的体积为![]() L=24mL,则C点氢氧化钠溶液的体积为31mL﹣24mL=7mL,故D正确;
L=24mL,则C点氢氧化钠溶液的体积为31mL﹣24mL=7mL,故D正确;
故选:BD。


科目:高中化学 来源: 题型:
【题目】Na2SO3是一种白色粉末,工业上可用作还原剂、防腐剂等。某化学小组探究不同pH的Na2SO3溶液与同浓度AgNO3溶液反应的产物,进行如下实验。
I.(1)配制500mL一定浓度的Na2SO3溶液
①溶解:准确称取一定质量的Na2SO3晶体,用煮沸的蒸馏水溶解。蒸馏水需煮沸的原因是___。
②移液:将上述溶解后的Na2SO3溶液在烧杯中冷却后转入仪器A中,则仪器A为_,同时洗涤___(填仪器名称)2~3次,将洗涤液一并转入仪器A中;
③定容:加水至刻度线1~2cm处,改用胶头滴管滴加蒸馏水至液面与刻度线相切,盖好瓶塞,反复上下颠倒,摇匀。
Ⅱ.探究不同pH的Na2SO3溶液与pH=4的AgNO3溶液反应的产物
查阅资料:i.Ag2SO3为白色固体,不溶于水,溶于过量Na2SO3溶液
ii.Ag2O,棕黑色固体,不溶于水,可与浓氨水反应
(2)将pH=8的Na2SO3溶液滴人pH=4的AgNO3溶液中,至产生白色沉淀。
假设一:该白色沉淀为Ag2SO3
假设二:该白色沉淀为Ag2SO4
假设三:该白色沉淀为Ag2SO3和Ag2SO4的混合物
①写出假设一的离子方程式__;
②提出假设二的可能依据是___;
③验证假设三是否成立的实验操作是__。
(3)将pH=4的AgNO3溶液逐滴滴人足量的pH=11的Na2SO3溶液中,开始产生白色沉淀A,然后变成棕黑色物质。为了研究白色固体A的成分,取棕黑色固体进行如下实验:

①已知反应(b)的化学方程式为Ag(NH3)2OH+3HCl=AgCl↓+2NH4Cl+H2O,则反应(a)的化学方程式为___;
②生成白色沉淀A的反应为非氧化还原反应,则A的主要成分是__(写化学式)。
(4)由上述实验可知,盐溶液间的反应存在多样性。经验证,(2)中实验假设一成立,则(3)中实验的产物不同于(2)实验的条件是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据反应:2Na2CO3+SnO2+4S![]() Na2SO4+Na2SnS3+2CO2,回答下列问题:
Na2SO4+Na2SnS3+2CO2,回答下列问题:
(1)上述反应涉及的元素中,非金属性最强的元素最外层电子排布式为_____。
在上述反应的生成物中,属于分子晶体的化合物的结构式为_____。
(2)在上述反应中单质物质的原子核外共有_____种不同运动状态的电子,有_____种不同能量的电子。
(3)上述反应中,金属性最强的元素与铝元素相比较,可以作为判断两者金属性强弱依据的是_____(选填编号)。
a.能否置换出硫酸铜溶液中的铜离子
b.Al(OH)3能否溶解在该元素最高价氧化物对应的水化物中
c.单质与氯气化合时失去电子数目的多少
d.单质与同浓度的稀盐酸发生反应的剧烈程度
(4)上述反应中氧化剂与还原剂的物质的量之比是_____。
(5)常温下,测得Na2SnS3溶液pH>7,请用离子方程式解释其原因:_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把10.2g镁铝合金的粉末放入过量的盐酸中,得到11.2L H2(标准状况下).试计算(写出计算过程):
(1)该合金中铝的质量分数;
(2)该合金中铝和镁的物质的量之比.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究电化学腐蚀及防护的装置如右图所示。下列有关说法错误的是( )

A. d为石墨,铁片腐蚀加快
B. d为石墨,石墨上电极反应为:O2 + 2H2O + 4e == 4OH–
C. d为锌块,铁片不易被腐蚀
D. d为锌块,铁片上电极反应为:2H+ + 2e == H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图所示装置分别进行下列实验:将①中溶液滴入②中,按要求填写下列空格:

方案 | ①中物质 | ②中物质 | 填空编号及要求 |
实验1 | 滴加过酚酞的水 | Na2O2 | 写出会看到的现象①_____ |
实验2 | NaOH溶液 | 未打磨过的铝条 | 写出所发生反应的离子方程式 ②_____ |
实验3 | 盐酸 | NaAlO2溶液 | 画出生成沉淀量随盐酸的加入的变化图象 ③_____ |
实验4 | 稀盐酸 | Na2CO3与NaOH的混合溶液 | 已知生成气体量随盐酸的加入的变化图象如下,则原溶液中的Na2CO3与NaOH的物质的量浓度之比为 ④_____
|
实验5 | FeCl3和盐酸的混合液 | 等质量的铜、锌、铁三种金属的混合物 | 若反应后无固体剩余,则反应后的溶液中一定存在的阳离子是 ⑤_____ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究氮及其化合物的性质及转化,对研究自然界中氮的循环有着重大的意义。
I.合成氨反应历程研究
(1)科学家研究利用铁触媒合成氨的反应历程如图所示,其中吸附在催化剂表面的物种用“ad”表示。
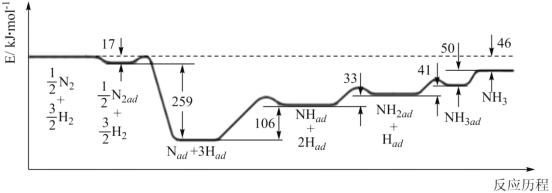
由图可知合成氨反应N2(g)+3H2(g)![]() 2NH3(g)的H=__kJ·mol-1。该历程中速率最慢的一步的化学方程式为__。
2NH3(g)的H=__kJ·mol-1。该历程中速率最慢的一步的化学方程式为__。
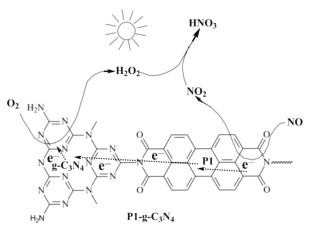
II.对NO与O2反应的研究
(2)用Pl-g-C3N4光催化氧化法脱除NO的过程如图所示。在酸性水溶液中,光催化脱除原理和电化学反应原理类似。g-C3N4端的反应为O2+2H++2e-=H2O2,则Pl端的反应为__。
(3)在一定条件下,将2molNO和1molO2通入恒容密闭容器中进行反应。在不同温度下,测得平衡时体系中NO、O2、NO2的物质的量与温度的关系如图所示。
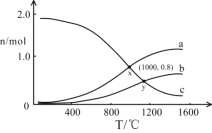
(已知:容器中发生两个反应2NO(g)+O2(g)![]() 2NO2(g) H0和2NO2(g)
2NO2(g) H0和2NO2(g)![]() N2O4(g) H0)
N2O4(g) H0)
①曲线c代表__的物质的量与温度的关系,x点对应的O2的转化率为__。
②下列说法正确的是__。
A.2NO+O2![]() 2NO2的平衡常数:x点>y点
2NO2的平衡常数:x点>y点
B.y点时2NO+O2![]() 2NO2的反应速率:v正<v逆
2NO2的反应速率:v正<v逆
C.x点对应的NO的物质的量分数为![]()
D.400~1200℃时,随温度升高,N2O4体积分数不断增大
III.对NO与Cl2物反应及产物NOCl(亚硝酰氯)的研究
(4)NOCl可由NO与Cl2制得,化学方程式为2NO(g)+Cl2(g)![]() 2NOCl ΔH=-111kJ/mol。在295K时,其反应物浓度与反应速率关系的数据如下:
2NOCl ΔH=-111kJ/mol。在295K时,其反应物浓度与反应速率关系的数据如下:
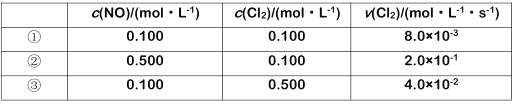
反应物浓度与反应速率关系式为v(Cl2)=k·cm(NO)cn(Cl2),式中速率常数k=Ae-Ea/RT,其中Ea为活化能,A、R均为大于0的常数,T为温度)。则此条件下k的数值为__,若要使k增大,可采取的措施有__、__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钠常用作漂白剂、杀菌剂、消毒剂,能与水和二氧化碳等物质发生反应,保存不当时容易变质。某实验小组以过氧化钠为研究对象进行了如下实验。
(1)探究一包Na2O2样品是否已经变质:取少量样品,将其溶解,加入__________溶液,充分振荡后有白色沉淀,证明Na2O2已经变质。
(2)该实验小组为了粗略测定过氧化钠的质量分数,称取了m g样品,并设计用如图装置来测定过氧化钠的质量分数。

①装置中仪器a的名称是_________,装置D的作用是________________;
②将仪器连接好以后,必须进行的第一步操作是_____________________;
③写出装置C中发生主要反应的化学方程式_______________________;
④反应结束后,在读取实验中生成气体的体积时,你认为合理的是________(填序号);
a.读取气体体积前,需冷却到室温
b.调整量筒使E、F内液面高度相同
c.视线与凹液面的最低点相平时读取量筒中水的体积
⑤读出量筒内水的体积后,将其折算成标准状况下氧气的体积为VmL,则样品中过氧化钠的质量分数为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A是一种重要的化工原料,以A为主要起始原料,通过下列途径可以合成高分子材料PA及PC。

试回答下列问题
(1)B的化学名称为_____________,B到C的反应条件是_____________;
(2)E到F的反应类型为_____________,高分子材料PA的结构简式为_____________;
(3)由A生成H的化学方程式为_______________________________________;
(4)实验室检验有机物A,可选择试剂_____________或_____________;
(5)E的同分异构中,既能与碳酸氢钠溶液反应又能发生银镜反应的有机物共有_____________种。其中核磁共振氢谱图有5组峰,且峰面积之比为6:1:1:1:1的物质的结构简式为_____________;
(6)由B通过三步反应制备1,3-环己二烯的合成路线为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com