
【题目】从能量的变化和反应的快慢等角度研究化学反应具有重要意义。
(1)已知一定条件下,反应N2+3H2![]() 2NH3为放热反应;:
2NH3为放热反应;:
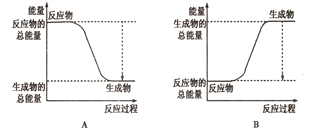
①下图能正确表示该反应中能量变化的是________;
②根据下表数据,计算生成1molNH3时该反应放出的热量为______kJ;
化学键 | H-H | N≡N | N-H |
断开1mol键所吸收的能量 | 436kJ | 946kJ | 391kJ |
③一定温度下,将3molH2和1molN2通入容积为2L的密闭容器中发生反应,5min达到平衡,测得c(NH3)=0.4mol/L,则O至5min时![]() (N2)=______,反应开始与平衡时气体的物质的量之比为__________;
(N2)=______,反应开始与平衡时气体的物质的量之比为__________;
(2)原电池可将化学能转化为电能。由A、B、C、D四种金属按下表中装置进行实验:
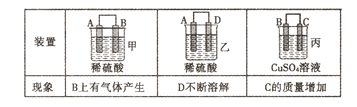
①装置甲甲SO42-向________ 极移动(填“A”或“B”);
②四种金属活动性由强到弱的顺序是____;
③若装置丙中的电极为质量相等的铁棒和铜棒,电池工作一段时间后.取出洗净、干燥、称量.两电极质量差为6g。则导线中通过电子的物质的量为______mol。
【答案】 A 46 0.04moI/(L·min) 5:4 A D>A>B>C 0.1
【解析】(1)①反应放热,说明反应物的总能量高于生成物的总能量,因此能正确表示该反应中能量变化的是A;②反应热等于断键吸收的总能量和形成化学键所放出的总能量的差值,则生成1molNH3时该反应放出的热量为(2×3×391-946-3×436)kJ/2=46kJ;③5min达到平衡,测得c(NH3)=0.4mol/L,则消耗氮气是0.2mol/L,因此O至5min时用氮气表示的反应速率是0.2mol/L÷5min=0.04moI/(L·min)。平衡时剩余氮气是1mol-0.2mol/L×2L=0.6mol,氢气是3mol-0.6mol/L×2L=1.8mol,所以反应开始与平衡时气体的物质的量之比为![]() ;(2)甲中B电极上产生气体,B是正极,A是负极,乙中D电极不断溶解,D是负极,A是正极,丙中C的质量增加,C是正极,B是负极,则金属性强弱顺序是D>A>B>C。①原电池阴离子向负极移动,则装置甲中硫酸根离子向A极移动;②根据以上分析可知四种金属活动性由强到弱的顺序是D>A>B>C;③设消耗铁是xmol,则同时析出铜是xmol,因此有56x+64y=6,解得x=0.05,则导线中通过电子的物质的量为0.05mol×2=0.1mol。
;(2)甲中B电极上产生气体,B是正极,A是负极,乙中D电极不断溶解,D是负极,A是正极,丙中C的质量增加,C是正极,B是负极,则金属性强弱顺序是D>A>B>C。①原电池阴离子向负极移动,则装置甲中硫酸根离子向A极移动;②根据以上分析可知四种金属活动性由强到弱的顺序是D>A>B>C;③设消耗铁是xmol,则同时析出铜是xmol,因此有56x+64y=6,解得x=0.05,则导线中通过电子的物质的量为0.05mol×2=0.1mol。


 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是
A. 甲苯分子中所有原子在同一平面上
B. 苯、乙酸、乙醇均能发生取代反应
C. 分子式为C3H6Cl2的同分异构体共有4种(不考虑立体异构)
D. 可用溴的四氯化碳溶液区别![]() 和
和![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Mg﹣AgCl电池是一种以海水为电解质溶液的水激活电池.下列叙述错误的是( )
A.负极反应式为Mg﹣2e﹣=Mg2+
B.正极反应式为Ag++e﹣=Ag
C.电池放电时Cl﹣由正极向负极迁移
D.负极会发生副反应Mg+2H2O=Mg(OH)2+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,0.1mol/L某一元酸HA的水溶液PH=4.下列描述不正确的是( )
A.该溶液中HA有0.1%发生了电离
B.此酸电离平衡常数约为10﹣7
C.升高温度后溶液的PH增大
D.若将PH=2的HA溶液与PH=12的NaOH溶液等体积混合后PH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧是理想的烟气脱硝剂,其脱硝反应为:2NO2(g)+O3(g)N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图象作出的判断正确的是( )
A | B | C | D |
|
|
|
|
升高温度,平衡常数增大 | 0~3s内,反应速率为: | t1时仅加入催化剂,平衡正向移动 | 达平衡时,仅改变x,则x为c(O3) |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、D、E均为中学化学中的常见物质,它们之间的转化关系如图所示(部分产物略去),则下列有关物质的推断不正确的是( )

A. 若A是铁,则E可能为稀硝酸
B. 若A是CuO,E是碳,则B为CO
C. 若A是NaOH溶液,E是CO2,则B为NaHCO3
D. 若A是AlCl3溶液,E不可能是NaOH溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com