
| A£®ĻņNa2S03ČÜŅŗÖŠ¼ÓČėĻõĖįĖį»ÆµÄBaCl2ČÜŅŗ£¬ÓŠ°×É«³Įµķ³öĻÖ£¬ĖµĆ÷Na2S03ČÜ ŅŗŅŃ¾±äÖŹ |
| B£®ĻņŌķ»Æ·“Ó¦ŗóµÄ»ģŗĻĪļÖŠ¼ÓČėŹ³ŃĪæÉ·ÖĄė³öøß¼¶Ö¬·¾ĖįÄĘ£¬ĖµĆ÷øß¼¶Ö¬·¾ĖįÄĘŌŚ “ĖŹ±ČŻŅ×Īö³ö |
C£®µČĢå»ż”¢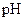 ¶¼ĪŖ3µÄĖįHAŗĶHB·Ö±šÓė×ćĮæµÄŠæ·“Ó¦£¬HA·Å³öµÄĒāĘų¶ą£¬Ėµ ¶¼ĪŖ3µÄĖįHAŗĶHB·Ö±šÓė×ćĮæµÄŠæ·“Ó¦£¬HA·Å³öµÄĒāĘų¶ą£¬ĖµĆ÷ĖįŠŌ£ŗ 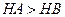 |
D£®ĻņÅØ¶Č¾łĪŖ0.1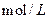 µÄMgCl2”¢CuCl2»ģŗĻČÜŅŗÖŠÖšµĪ¼ÓČėÉŁĮæ°±Ė®£¬ĻČÉś³É µÄMgCl2”¢CuCl2»ģŗĻČÜŅŗÖŠÖšµĪ¼ÓČėÉŁĮæ°±Ė®£¬ĻČÉś³É |
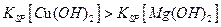
 ĆĻ½ØĘ½Š”ѧ¹ö¶Æ²āŹŌĻµĮŠ“š°ø
ĆĻ½ØĘ½Š”ѧ¹ö¶Æ²āŹŌĻµĮŠ“š°ø »ĘøŌĢģĢģĮ·æŚĖćĢāæØĻµĮŠ“š°ø
»ĘøŌĢģĢģĮ·æŚĖćĢāæØĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
A£® ”¢Al3+”¢ ”¢Al3+”¢ ”¢ ”¢ |
B£®K+”¢Na+”¢S2-”¢ |
C£®K+”¢ ”¢ ”¢ ”¢ ”¢ |
D£®Na+”¢K+”¢ ”¢ ”¢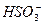 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®Na+”¢Cu2+”¢NO3£ | B£®NO3£”¢Fe2+”¢H+ |
| C£®Ba2+”¢Cl£”¢SO32£ | D£®H+”¢SiO32”Ŗ”¢Na+ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®K+ HCO3- NO3- ClO- | B£®Na+ SO32- NH4+ Ba2+ |
| C£®Ba2+ S2- Cl- SO42- | D£®Al3+ NO3- Cl- Na+ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
A£®pH¾łĪŖ11µÄNaOHŗĶ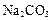 ČÜŅŗÖŠ£¬ÓÉĖ®µēĄė²śÉśµÄ ČÜŅŗÖŠ£¬ÓÉĖ®µēĄė²śÉśµÄ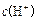 ĻąĶ¬ ĻąĶ¬ |
| B£®pH¾łĪŖ11”¢µČĢå»żµÄNaOHČÜŅŗŗĶ°±Ė®£¬¼ÓČėµČĢå»żµÄĖ®ŗó£¬Ē°ÕßµÄpH“óÓŚŗóÕß |
C£®0.1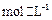 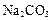 ČÜŅŗÖŠ£ŗ ČÜŅŗÖŠ£ŗ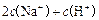  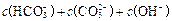 |
| D£®µČĢå»ż”¢µČĪļÖŹµÄĮæÅØ¶ČµÄŅŅĖįŗĶŅŅĖįÄĘČÜŅŗ»ģŗĻŗó³ŹĖįŠŌ£¬Ōņ |
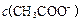 £¾
£¾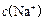 £¾
£¾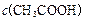 £¾
£¾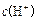 £¾
£¾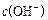
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
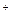 ӢNH4
ӢNH4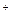 ӢFe3
ӢFe3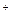 ӢSO3
ӢSO3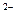 ӢHCO3
ӢHCO3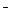 ӢBr
ӢBr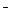 Ӣ
”¢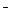 £¬ĪŖ¼ģŃéĘä³É·Ö£¬ĻȶŌČÜŅŗ½ųŠŠ³õ²½·ÖĪö”£ĻĀĮŠÅŠ¶ĻÖŠ£¬²»ÕżČ·µÄŹĒ
£¬ĪŖ¼ģŃéĘä³É·Ö£¬ĻȶŌČÜŅŗ½ųŠŠ³õ²½·ÖĪö”£ĻĀĮŠÅŠ¶ĻÖŠ£¬²»ÕżČ·µÄŹĒA£®ČÜŅŗÖŠ²»“ęŌŚ“óĮæHCO3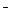 ŗĶSCN ŗĶSCN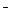 |
| B£®ČÜŅŗÖŠŅ»¶Ø“ęŌŚ“óĮæFe3£« |
C£®ČÜŅŗæÉÄÜŗ¬ÓŠAg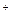 |
D£®ČÜŅŗÖŠæÉÄÜ“ęŌŚNH4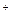 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
A£®NH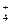 ”¢Na+”¢NO ”¢Na+”¢NO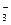 ”¢S2£ ”¢S2£ | B£®Na+”¢K+”¢CH3COOŅ»”¢HCO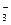 |
C£®K+”¢NO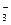 ”¢SO ”¢SO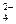 ”¢Cl”Ŗ ”¢Cl”Ŗ | D£®K+”¢Al3+”¢MnO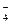 ”¢NO ”¢NO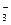 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
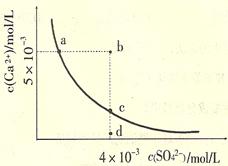
| A£®³£ĪĀĻĀCaSO4±„ŗĶČÜŅŗÖŠ£¬c(Ca2+)”¢c(SO42-)¶ŌÓ¦ĒśĻßÉĻČĪŅāŅ»µć |
| B£®bµć½«ÓŠ³ĮµķÉś³É£¬Ę½ŗāŗóČÜŅŗÖŠc(SO42-)Ņ»¶ØµČÓŚ3”Įl0-3mol/L |
| C£®dµćČÜŅŗĶعżÕō·¢æÉŅŌ±äµ½cµć |
| D£®aµć¶ŌÓ¦µÄKspµČÓŚcµć¶ŌÓ¦µÄKsp |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®³£ĪĀĻĀ£¬c(H+)/c(OH-)=1”Į10-12µÄČÜŅŗ£ŗI£”¢Cl£”¢HCO3£”¢Na+ |
| B£®ŗ¬ÓŠ“óĮæFe3+µÄČÜŅŗ£ŗNa+”¢HCO3£”¢NO3£”¢CO32£ |
C£®¼ÓČėĀĮ·ŪÄܲśÉśĒāĘųµÄČÜŅŗ£ŗCl£ ”¢Na+”¢SO42£”¢NO3£ ”¢Na+”¢SO42£”¢NO3£ |
| D£®ÓÉĖ®µēĄė³öµÄc(H+)=1”Į10-12 mol?L£1ČÜŅŗÖŠ£ŗK+”¢Cl£”¢NO3£”¢Na+ |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com