
分析 题中Cu(NO3)2、AlCl3、FeCl3为强酸弱碱盐,水解呈酸性;Na2CO3为强碱弱酸盐,水解呈碱性;Na2SO4为强酸强碱盐,不水解;NaHSO4为强酸强碱的酸式盐,电离显酸性,以此解答该题
解答 解:(1)Na2SO4为强酸强碱盐,不水解,溶液显中性,故答案为:中性;无;
(2)Cu(NO3)2是强酸弱碱盐,水解显酸性,水解的离子方程式为:Cu2++2H2O?Cu(OH)2+2H+,故答案为:酸性;Cu2++2H2O?Cu(OH)2+2H+;
(3)FeCl3为强酸弱碱盐,水解显酸性,水解的离子方程式为:Fe3++3H2O?Fe(OH)3+3H+,故答案为:酸性;Fe3++3H2O?Fe(OH)3+3H+;
(4)AlCl3为强酸弱碱盐,水解显酸性,水解的离子方程式为:Al3++3H2O?Al(OH)3+3H+,故答案为:酸性;Al3++3H2O?Al(OH)3+3H+;
(5)Na2CO3为强碱弱酸盐,水解显碱性,离子方程式为:CO32-+H2O?HCO3-+OH-,HCO3-++H2O?H2CO3+OH-,故答案为:碱性;CO32-+H2O?HCO3-+OH-,HCO3-++H2O?H2CO3+OH-;
(6)NaHSO4为强酸强碱的酸式盐,电离显酸性,不能水解,故答案为:酸性;无.
点评 本题考查了盐类水解的条件以及规律,应注意的是盐类若水解,则必须结构中含弱离子,且谁强显谁性.


科目:高中化学 来源: 题型:选择题
| A. | 离子半径:r(Z2+)>r(Y2-) | |
| B. | Y的气态简单氢化物的热稳定性比氮元素的气态简单氢化物强 | |
| C. | Y分别与Z、W形成的化合物中化学键类型相同 | |
| D. | X、Y、Z、W元素的最高正价均等于其所在族的族序数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化氯具有强氧化性,可用于杀菌消毒 | |
| B. | 氢氧化铝具有弱碱性,可用于治疗胃酸过多 | |
| C. | 二氧化硅的熔沸点很高,可用于制作石英坩埚 | |
| D. | 钠钾合金的密度小,可用于快中子反应堆的热交换剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使甲基橙变红色的溶液中:Ca2+、Mg2+、HCO3-、Cl- | |
| B. | 使KSCN变红色的溶液中:NH4+、S2-、Br-、I- | |
| C. | c(H+)/c(OH-)=1012 的溶液中:Cu2+、Al3+、NO3-、SO42- | |
| D. | 由水电离产生的c(H+)•c(OH-)=10-8的溶液中:Na+、K+、AlO2-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
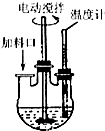 实验室制取高纯NaI晶体(无色)可按下列步骤进行:按化学计量称取各原料,在三颈烧瓶中(如图)先加入适量的高纯水,然后按Na2CO3、I2和水合肼的投料顺序分批加入.
实验室制取高纯NaI晶体(无色)可按下列步骤进行:按化学计量称取各原料,在三颈烧瓶中(如图)先加入适量的高纯水,然后按Na2CO3、I2和水合肼的投料顺序分批加入.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 混合溶液/实验 | A | B | C | D | E | F |
| 4mol•L-1H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | 实验温度/℃ | c(Na2S2O3)/mol•L-1 | c(H2SO4)/mol•L-1 |
| ① | 25 | 0.1 | 0.1 |
| ② | 25 | 0.2 | 0.2 |
| ③ | 50 | 0.2 | 0.1 |
| ④ | 50 | 0.1 | 0.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
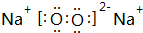 (写一种);
(写一种);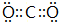 (写一种).
(写一种).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
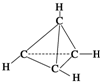 一种有机物的分子式为C4H4,分子结构如图所示,将该有机物与适量氯气混合后光照,生成的氯代物的种类共有( )
一种有机物的分子式为C4H4,分子结构如图所示,将该有机物与适量氯气混合后光照,生成的氯代物的种类共有( )| A. | 2 种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com