
| A. | 单质钠放入水中,产生气体:Na+H2O═Na++OH-+H2↑ | |
| B. | 单质铁与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | AlCl3溶液中加入过量氨水:Al3++3OH-═Al(OH)3↓ | |
| D. | Ca(HCO3)2溶液中加入少量NaOH:Ca2++OH-+HCO3-═CaCO3↓+H2O |
分析 A.原子个数不守恒;
B.不符合反应客观事实;
C.一水合氨为弱碱,应保留化学式;
D.氢氧化钠少量,反应生成碳酸钙、碳酸氢钠和水.
解答 解:A.单质钠放入水中,产生气体,离子方程式:2Na+2H2O═2Na++2OH-+H2↑,故A错误;
B.单质铁与稀硫酸反应,离子方程式:Fe+2H+═Fe2++H2↑,故B错误;
C.AlCl3溶液中加入过量氨水,离子方程式:Al3++3NH3•H2O=Al (OH)3↓+3NH4+,故C错误;
D.Ca(HCO3)2溶液中加入少量NaOH,离子方程式:Ca2++OH-+HCO3-═CaCO3↓+H2O,故D正确;
故选:D.
点评 本题考查了离子方程式的书写,明确物质的性质及反应实质是解题关键,注意离子反应遵循客观事实、遵循电荷守恒、原子个数守恒规律,题目难度不大.


科目:高中化学 来源: 题型:多选题
| A. | 凡pH<7的雨水就可看作“酸雨” | |
| B. | 燃烧不一定要有氧气的参加,但燃烧一定是氧化还原反应 | |
| C. | 用NaClO溶液代替Cl2作为漂白剂是由于它难分解且在空气中可转化为HClO | |
| D. | 玻璃是氧化物,成分可表示为Na2OCaO•6SiO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
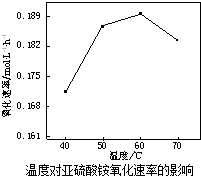 利用氨水吸收烟气中的二氧化硫,其相关反应的主要热化学方程式如下:
利用氨水吸收烟气中的二氧化硫,其相关反应的主要热化学方程式如下: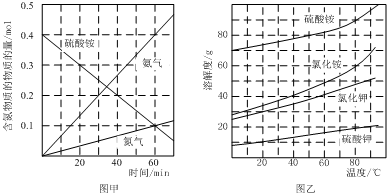
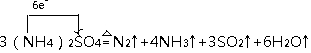 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在4mL0.1mol/L的K2Cr2O7溶液中滴加数滴1mol/LNaOH溶液,溶液颜色从橙色变成黄色 | |
| B. | 向Na2S2O3溶液中滴入足量稀硫酸,溶液最终为无色 | |
| C. | 向血红色的Fe(SCN)3溶液中加入少量KI固体,溶液颜色变浅 | |
| D. | 用50mL针筒抽取30mL红棕色的NO2气体并封住注射孔,当用力推压活塞,压缩针筒中的气体(此过程中不考虑温度变化),气体颜色逐渐变浅 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
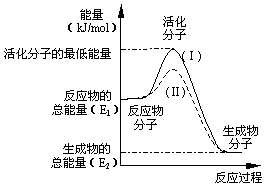 请认真观察图并利用所学的活化能的知识,回答下列问题:
请认真观察图并利用所学的活化能的知识,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | abc | B. | bcd | C. | abd | D. | abcd |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
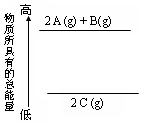
| A. | 2A+B=2C;△H<0 | B. | 2C(g)=2 A(g)+B(g);△H<0 | ||
| C. | 2A(g)+B(g)=2 C(g);△H>0 | D. | 2A(g)+B(g)=2 C(g);△H<0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com