
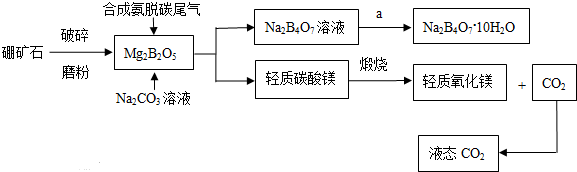
分析 (1)硼酸与水作用时,与水电离产生的OH-结合,生成[B(OH)4]-,离子方程式为:B(OH)3+H2O?H++[B(OH)4]-;
(2)①甲烷与水反应生成氢气和二氧化碳;
②所得气体经浓硫酸吸收,浓硫酸增重0.45g,说明生成的水为0.45g,CO2为:2.33g-1g-0.45g=0.88g;
xMgCO3.yMg(OH)2.zH2O=(x+y)MgO+xCO2↑+(y+z)H2O
40(x+y) 44x 18(y+z)
1g 0.88g 0.45g,
解之得x=4,y=1,z=4;
③根据题意,Mg2B2O5、Na2CO3、CO2与H2O反应生成硼砂和轻质碳酸镁,注意方程式的配平;
④由硼砂溶液制取硼砂晶体需要蒸发浓缩、冷却结晶;
⑤由流程图可知,轻质碳酸镁、轻质氧化镁、态二氧化碳都是产品,属于联产产品.
解答 解:(1)硼酸与水作用时,与水电离产生的OH-结合,生成[B(OH)4]-,离子方程式为:B(OH)3+H2O?H++[B(OH)4]-;该物质的电离方式与NH3或Al(OH)3 与水的电离类似,Al(OH)3+H2O?[Al(OH)4]-+H+;
故答案为:H3BO3+H2O?[B(OH)4]-+H+;NH3或Al(OH)3;
(2)①甲烷与水反应生成氢气和二氧化碳,方程式为CH4+2H2O$\frac{\underline{\;高温\;}}{\;}$CO2+4H2,故答案为:CH4+2H2O$\frac{\underline{\;高温\;}}{\;}$CO2+4H2;
②所得气体经浓硫酸吸收,浓硫酸增重0.45g,说明生成的水为0.45g,CO2为:2.33g-1g-0.45g=0.88g;根据反应:
xMgCO3.yMg(OH)2.zH2O=(x+y)MgO+xCO2↑+(y+z)H2O
40(x+y) 44x 18(y+z)
1g 0.88g 0.45g,
解之得x=4,y=1,z=4;
故答案为:4MgCO3•Mg(OH)2•4H2O;
③根据题意,Mg2B2O5、Na2CO3、CO2与H2O反应生成硼砂和轻质碳酸镁,方程式为10Mg2B2O5+5Na2CO3+11CO2+20H2O=5Na2B4O7+4[4MgCO3.Mg(OH)2.4H2O]↓;
故答案为:10Mg2B2O5+5Na2CO3+11CO2+20H2O=5Na2B4O7+4[4MgCO3.Mg(OH)2.4H2O]↓;
④由硼砂溶液制取硼砂晶体需要蒸发浓缩、冷却结晶;故答案为:蒸发浓缩、冷却结晶;
⑤由流程图可知,轻质碳酸镁、轻质氧化镁、态二氧化碳都是产品,属于联产产品;纯碱是反应物之一,不是产品,故答案为:abc.
点评 本题考查了硼砂的制备、复杂化学式的计算,题目难度稍大,计算是难点,计算时要充分利用题目所给数量关系和表中数据,根据质量关系和质量分数的概念快速解题.


科目:高中化学 来源: 题型:解答题
 据2004年1月17日网易报道,意大利科学家使用普通氧分子和带正电的氧化离子作用,制出了新型的氧分子O4,它的结构很复杂,可能具有与S4相似的长方形结构,是一种高能量分子.
据2004年1月17日网易报道,意大利科学家使用普通氧分子和带正电的氧化离子作用,制出了新型的氧分子O4,它的结构很复杂,可能具有与S4相似的长方形结构,是一种高能量分子.
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 硫是氧化剂,KOH是还原剂 | |
| B. | 反应中共转移4摩尔电子 | |
| C. | 还原剂和氧化剂质量比是1:2 | |
| D. | 氧化产物和还原产物的质量比是1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 钠和钾的合金具有导电性,可用于中子反应堆热交换剂 | |
| B. | 采用催化措施,将汽车尾气中的CO和NO转化为无害气体 | |
| C. | 信息产业中的光缆的主要成分是单质硅 | |
| D. | 水玻璃易溶于水,可用于生产黏合剂和防火剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酯的一般通式是RCOOR′和R′可以相同,也可以不同 | |
| B. | RCOOR′和R′可以是脂肪烃基,也可以是芳香烃基 | |
| C. | 在RCOOR′中,当R和R′均为-CH3时,这种酯叫甲酸甲酯 | |
| D. | 碳原子数相同的饱和一元羧酸和饱和一元酯互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
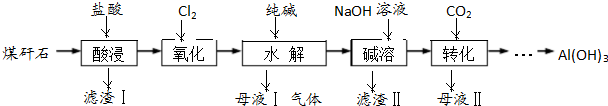
 铝、铁及其化合物在工业生产中有着重要的应用.
铝、铁及其化合物在工业生产中有着重要的应用.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com