
| A. | Cu(OH)2+HC1; Cu(OH)2+CH3COOH | B. | NaHCO3+H2SO4;Na2CO3+HCl | ||
| C. | NaHS04+NaOH; H2SO4+NaOH | D. | BaCl2与 Na2SO4;Ba(OH)2 与 CuSO4 |
分析 A.氯化氢为强电解质,而醋酸为弱电解质,离子方程式中需要保留分子式;
B.碳酸氢钠、碳酸钠在离子方程式中分别形成碳酸氢根离子、碳酸根离子形式;
C.NaHSO4+NaOH;H2SO4+NaOH,两个反应的实质都是氢离子与氢氧根离子反应生成水;
D.氢氧化钡与硫酸反应除了生成硫酸钡沉淀,还有水生成.
解答 解:A.Cu(OH)2+HCl的离子方程式为:Cu(OH)2+2H+═Cu2++2H2O;醋酸为弱酸,离子方程式中需要保留分子式,醋酸与氢氧化铜反应的离子方程式为:Cu(OH)2+2CH3COOH═Cu2++2H2O+2CH3COO-,两个反应的离子方程式不同,故A错误;
B.NaHCO3+H2SO4的离子方程式为:HCO3-+H+═C02↑+H20;Na2CO3+HCl的离子方程式为:CO32-+2H+═CO2↑+H2O,两个反应的离子方程式不同,故B错误;
C.NaHSO4+NaOH和H2SO4+NaOH都是可溶性的强碱与强酸反应生成可溶性的盐和水,其离子方程式都可以用OH-+H+═H2O表示,故C正确;
D.BaCl2+H2SO4的离子方程式为:SO42-+Ba2+=BaSO4↓;Ba(OH)2+H2SO4,二者反应生成硫酸钡和水,反应的离子方程式为:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,两个反应的离子方程式不同,故D错误;
故选C.
点评 本题考查了离子方程式的正误判断,属于中等难度的试题,注意明确判断离子方程式正误常用方法,该题有助于培养学生分析问题、解决问题的能力.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
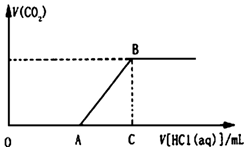 向100mL某物质的量浓度的NaOH溶液中缓慢通入一定量的CO2,使其充分反应.在上述所得溶液中,逐滴缓慢滴加1mol•L-1的盐酸,所得气体(不考虑溶解)的体积与滴加盐酸的体积关系如图(其中点A是线段OC上的动点):
向100mL某物质的量浓度的NaOH溶液中缓慢通入一定量的CO2,使其充分反应.在上述所得溶液中,逐滴缓慢滴加1mol•L-1的盐酸,所得气体(不考虑溶解)的体积与滴加盐酸的体积关系如图(其中点A是线段OC上的动点):查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向豆浆中加入硫酸钙做豆腐 | |
| B. | 将植物油倒入水中用力搅拌形成油水混合物 | |
| C. | 利用丁达尔效应可以区别溶液与胶体 | |
| D. | 观看电影时,从放映机到银幕有明显的光路 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化还原反应中氧化剂和还原剂一定是两种物质 | |
| B. | 氧化还原反应中氧化产物和还原产物一定是两种物质 | |
| C. | 作氧化剂的物质一定不能作还原剂 | |
| D. | 所含元素处于中间价态时的物质,既可作氧化剂也可作还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 需要加热才能发生的反应一定是吸热反应,吸热反应的生成物总能量一定高于反应物总能量 | |
| B. | 同温同压下,H2(g)+Cl2(g)═2HCl(g) 在光照和点燃条件下的△H不同 | |
| C. | 一定条件下,0.5 mol N2和1.5 mol H2置于某密闭容器中充分反应生成NH3气,放热19.3kJ,其热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ/mol | |
| D. | 一定条件下4 HCl(g)+O2(g)═2Cl2(g)+2H2O(g),当1 mol O2反应放出115.6 kJ热量,键能如下所示,则断裂1 mol H-O键与断裂1 mol H-Cl键所需能量差为31.9 kJ Cl2(g)$\stackrel{243kJ/mol}{→}$2Cl(g) O2(g)$\stackrel{498kJ/mol}{→}$2O(g) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com