
 ,
,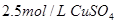 溶液,如有
溶液,如有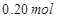 电子发生转移,试回答下列问题:
电子发生转移,试回答下列问题: 的质量是 ,得到
的质量是 ,得到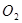 的体积(标准状况)是 。
的体积(标准状况)是 。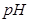 (填“变小”、“变大”或“不变”)
(填“变小”、“变大”或“不变”)

科目:高中化学 来源:不详 题型:单选题
| A.负极反应为:14H20+702+28e-=280H- |
| B.放电一段时间后,负极周围pH升高 |
| C.每消耗1 mol C2H6,则电路上转移的电子为14 mol |
| D.放电过程中KOH的物质的量浓度不变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
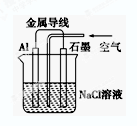
| A.铝是负极,铝片上析出无色气体 |
| B.石墨是正极,石墨棒上析出黄绿色气体 |
| C.溶液中两电极间产生白色沉淀 |
| D.溶液中Na+向石墨方向移动 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.负极有Cl2逸出,正极有H2逸出 | B.负极附近Cl-的浓度逐渐减小 |
| C.正极附近Cl-的浓度逐渐增大 | D.溶液中Cl-的浓度基本不变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
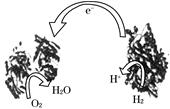
| A.左边为该电池的负极 |
| B.该电池可在高温环境下使用 |
| C.该电池负极反应为:H2-2e-=2H+ |
| D.该电池正极反应为O2+4e-=2O2- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
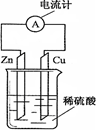
| A.电子由铜片通过导线流向锌片 |
| B.烧杯中溶液逐渐呈蓝色 |
| C.锌片逐渐溶解 |
| D.该装置能将电能转变为化学能 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 实验装置 | 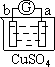 | 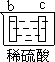 | 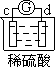 | 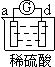 |
| 部分实验现象 | a极质量减小 b极质量增加 | b极有气体产生 c极无变化 | d极溶解 c极有气体产生 | 电流计指示在导线中 电流从a极流向d极 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 Zn2++Cu,该反应的原电池组成正确的是
Zn2++Cu,该反应的原电池组成正确的是| | A | B | C | D |
| 正极 | Cu | Zn | Ag | Cu |
| 负极 | Zn | Cu | Cu | Zn |
| 电解质溶液 | CuSO4 | CuCl2 | H2SO4 | 酒精 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.实验①、②说明锌能与稀硫酸反应而铜不能 |
| B.实验③说明发生原电池反应时会加快化学反应速率 |
| C.实验③说明在该条件下铜可以与稀硫酸反应生成氢气 |
| D.实验③、④说明该原电池中铜为正极、锌为负极 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com