
水的电离过程为H2O⇌H++OH﹣,在25℃时,水的离子积:KW=1×10﹣14,在35℃时,水的离子积:KW(35℃)=2.1×10﹣14,则下列叙述正确的是( )
|
| A. | c(H+)随着温度的升高而降低 |
|
| B. | 35℃时,c(H+)<c(OH﹣) |
|
| C. | 35℃时的水比25℃时的水电离程度小 |
|
| D. | 水的电离是吸热的 |
考点:
水的电离.
专题:
电离平衡与溶液的pH专题.
分析:
水中存在电离平衡,电离过程是吸热过程,温度升高促进电离,氢离子浓度和氢氧根离子浓度增大;水中氢离子浓度始终等于氢氧根离子浓度,水是中性.
解答:
解:A.温度升高促进水的电离,氢离子浓度增大,故A错误;
B.在35℃时水电离出的氢离子浓度和氢氧根离子浓度比25°C大,但氢离子浓度和氢氧根离子浓度是相同的,水仍是中性,故B错误;
C.水的电离是吸热过程,升温促进电离,35℃时的水比25℃时的水电离程度大,故C错误;
D.分析不同温度下其平衡常数,K(25℃)=1.0×l0﹣14,K(35℃)=2.1×l0﹣14.温度升高平衡常数增大,则水的电离是吸热过程,故D正确;
故选D.
点评:
本题考查水的电离平衡的影响因素分析,注意Kw只与温度有关,与氢离子的浓度无关,题目较简单.


 百年学典课时学练测系列答案
百年学典课时学练测系列答案科目:高中化学 来源: 题型:
下列关于乙烯的说法不正确的是( )
|
| A. | 乙烯是一种基本化工原料,其产量可用来衡量一个国家的石油化工发展水平 |
|
| B. | 乙烯是一种植物生长调节剂,可作为水果的催熟剂 |
|
| C. | 乙烯通入溴水中因发生取代反应而使溴水褪色 |
|
| D. | 乙烯可以和水发生加成反应生成乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
|
| A. | 1molNa2O2晶体中阴离子与阳离子之比为1:1 |
|
| B. | 1molSi晶体中含4molSi﹣Si键 |
|
| C. | 60gSiO2中含Si﹣O键的个数为4NA |
|
| D. | 12 g金刚石中含有C﹣C键的个数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
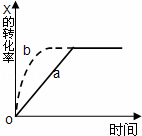
如图曲线a表示放热反应 X(g)+Y(g)⇌Z(g)+M(g)+N(s)△H<0进行过程中X的转化率随时间变化的关系.若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )
|
| A. | 升高温度 | B. | 加大X的投入量 |
|
| C. | 加催化剂 | D. | 增大体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在氨水中存在下列电离平衡:NH3•H2O⇌NH4++OH﹣,下列情况能引起电离平衡向正向移动的有( )
①加NH4Cl固体 ②加NaOH溶液 ③加HCl ④加CH3COOH溶液 ⑤加水 ⑥加压.
|
| A. | ①③⑤ | B. | ①④⑥ | C. | ③④⑤ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
pH值相同的醋酸和盐酸,分别用蒸馏水稀释到原来体积的m倍和n倍,稀释后两溶液的pH值仍相同,则m和n的关系是( )
|
| A. | m>n | B. | m=n | C. | m<n | D. | 不能确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
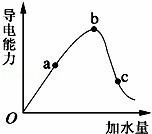
如图所示,一定温度下,冰醋酸加水稀释过程中溶液的导电能力曲线图,请回答.
(1)“O”点为什么不导电 .
(2)a、b、c三点的氢离子浓度由小到大的顺序为 .
(3)a、b、c三点中,醋酸的电离程度最大的一点是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
氨是一种重要的化工产品,是氮肥工业、有机合成工业以及制造硝酸、铵盐和纯碱等的原料。
(1)以氨为燃料可以设计制造氨燃料电池,因产物无污染,在很多领域得到广泛应用。若电极材料均为惰性电极,KOH溶液作电解质溶液,则该电池负极电极反应式为 。
(2)在一定温度下,在固定体积的密闭容器中进行可逆反应:N2+3H2 2NH3。该可逆反应达到平衡的标志是________________。
2NH3。该可逆反应达到平衡的标志是________________。
A.3v(H2)正=2v(NH3)逆
B.单位时间生成m mol N2的同时消耗3m mol H2
C.容器内的总压强不再随时间而变化
D.混合气体的密度不再随时间变化
E.a molN≡N键断裂的同时,有6amolN—H键断裂
F.N2、H2、NH3的分子数之比为1∶3∶2
(3)某化学研究性学习小组模拟工业合成氨的反应。在容积固定为2L的密闭容器内充入1molN2和3molH2,加入合适催化剂(体积可以忽略不计)后在一定温度压强下开始反应,并用压力计监测容器内压强的变化如下:
| 反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强/MPa | 16.80 | 14.78 | 13.86 | 13.27 | 12.85 | 12.60 | 12.60 |
则从反应开始到25min时,以N2表示的平均反应速率= ;该温度下平衡常数K= ;
(4)以CO2与NH3为原料合成尿素[化学式为CO(NH2)2]的主要反应如下,已知:
①2NH3(g)+CO2(g) == NH2CO2 NH4(s) △H= —l59.5 kJ·mol-1
②NH2CO2NH4(s)  CO(NH2)2(s)+H2O(g) △H=+116.5 kJ·mol-1
CO(NH2)2(s)+H2O(g) △H=+116.5 kJ·mol-1
③H2O(1) == H2O(g) △H=+44.0kJ·mol-1
写出CO2与NH3合成尿素和液态水的热化学反应方程式 ;
对于上述反应②在密闭容器中将过量NH2CO2NH4固体于300K下分解,平衡时P[H2O(g)]为a Pa,若反应温度不变,将体系的体积增加50%,则P[H2O(g)]的取值范围是_________________(用含a的式子表示)。(分压=总压×物质的量分数)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com