
| A. | 甲醇、甲醛分子间都可以形成氢键 | |
| B. | 甲醇分子内C原子C原子采取sp2杂化,O原子采取sp杂化 | |
| C. | 甲醛为极性分子,分子中两个C-H键夹角小于120° | |
| D. | 甲醇分子内的O-C-H键角大于甲醛分子内的O-C-H键角 |
分析 A.甲醇分子间都可以形成氢键,甲醛分子间不能形成氢键;
B.根据价层电子对互斥理论判断,价层电子对数=σ键+孤电子对;
C.甲醛分子是平面三角形,碳原子位于三角形内部,结构不对称,分子中两个C-H键夹角小于120°;
D.甲醇分子内的O-C-H键角为109°28′,甲醛分子略小于120度,据此分析解答.
解答 解:A.甲醇分子间存在着氢键,甲醛分子中O原子与水分子中H原子之间可以形成氢键,甲醛分子中,H原子与C原子相连,碳元素的电负性相对较小,甲醛分子间不能形成氢键,故A错误;
B.甲醇(CH3OH),分子内C原子价层电子对数=4+$\frac{4-4×1}{2}$=4,采取sp3杂化,O原子价层电子对数=2+$\frac{6-2×1}{2}$=4,采取sp3杂化,故B错误;
C.甲醛分子是平面三角形,碳原子位于三角形内部,结构不对称,所以极性分子,甲醛中C是sp2杂化,C-H与C-H键夹角理论上是120度,但由于有羰基氧的孤对电子的排斥,实际键角应该略小于120度,故C正确;
D.甲醇分子内C原子的杂化方式为sp3杂化,所以O-C-H键角约为109°28′,甲醛分子内的C原子的杂化方式为sp2杂化,O-C-H键角略小于120度,所以甲醇分子内的O-C-H键角小于甲醛分子内的O-C-H键角,故D错误;
故选C.
点评 本题考查氢键、价层电子对互斥理论、分子极性等,题目难度中等,注意理解杂化轨道理论与价层电子对互斥理论,进行分子构型的判断.


 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向硫酸氢钠溶液中滴加氢氧化钡溶液:Ba2++2OH-+2H++SO42-=BaS04↓+2H2O | |
| B. | 酸性介质中KMnO4氧化 H2O2:2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O | |
| C. | NaClO溶液中通入过量SO2:ClO-+SO2+H2O=HClO+HS03- | |
| D. | 向明矾溶液中滴加少量Ba(OH)22Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③④ | C. | ③④ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
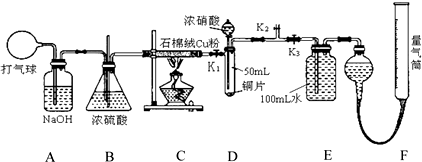
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 .有机物X的键线式为
.有机物X的键线式为 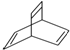 ,下列说法正确的是( )
,下列说法正确的是( )| A. | X的化学式为C8H10 | |
| B. | 有机物Y  与X互为同系物 与X互为同系物 | |
| C. | X因发生加成反应而使酸性高锰酸钾溶液褪色 | |
| D. | X与足量的H2在一定条件下反应可生成环状烃Z,Z的一氯代物有2种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{(N-M)}{45}$ | B. | $\frac{(M-N)}{45}$ | C. | $\frac{(M-N)}{90}$ | D. | $\frac{(N-M)}{90}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下,22.4L C5H10所含的碳原子数目为5NA | |
| B. | 常温常压下,7.8g过氧化钠含有的离子数为0.3NA | |
| C. | 18g水所含的电子数目为10NA | |
| D. | 3.2g O2、O3混合物中所含氧原子一定是0.2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com