
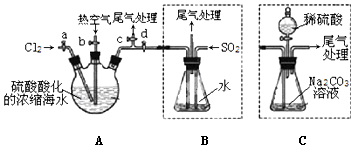
分析 ①连接A与B,关闭活塞b、d,打开活塞a、c,向A中缓慢通入Cl2至反应结束;
②关闭a、c,打开b、d,向A中鼓入足量热空气,吧生成的溴单质吹出;
③进行步骤②的同时,向B中通入足量SO2,是利用二氧化硫具有还原性能吸收溴单质;
④关闭b,打开a,再通过A向B中缓慢通入足量Cl2,是氧化溴化氢得到溴单质;
⑤将B中所得液体进行蒸馏,收集液溴,
(1)氯气为黄绿色气体,反应完毕应剩余氯气;
(2)溴易挥发;二氧化硫具有还原性,把单质溴还原为溴离子;
(3)步骤①制取溴,步骤②使溴挥发,步骤③吸收溴成溴离子,步骤④生成溴;
(4)溴、氯气和二氧化硫都有毒,可用碱液吸收;
(5)根据蒸馏所需仪器回答;由于题干中给出信息Br2的沸点是59℃,提纯溴必须收集59℃时的馏分,所以控制温度得到馏分是关键;
(6)根据题给信息,溴和碳酸钠反应生成了溴化钠和溴酸钠,化合价升降总数相等和原子守恒配平方程式.
解答 解:(1)氯气为黄绿色气体,反应完毕应剩余氯气,
故答案为:A中液面上方出现黄绿色气体;
(2)溴易挥发,升高温度促进其挥发,所以通入热空气的目的是吹出Br2;二氧化硫具有还原性,把单质溴还原为溴离子,反应的方程式为Br2+SO2+2H2O═4H++2Br-+SO42-;
故答案为:使A中生成的Br2随空气流进入B中;Br2+SO2+2H2O═4H++2Br-+SO42-;
(3)步骤①制取溴,步骤②使溴挥发,步骤③吸收溴成溴离子,步骤④生成溴,故这四步操作的最终目的为富集溴,
故答案为:富集溴;
(4)氯气不可能完全反应,氯气和溴离子反应生成溴单质,未反应的二氧化硫、氯气和溴都有毒,不能直接排空,且这几种物质都能和碱反应,所以用碱液吸收;
故答案为:c;
(5)蒸馏需要蒸馏烧瓶、冷凝管、酒精灯、温度计、牛角管和锥形瓶等;达到提纯溴的目的,操作中应控制的关键条件是把温度控制在溴的沸点59°C,并收集该温度下的馏分,
故答案为:冷凝管(或冷凝器);蒸馏烧瓶;控制温度计温度,并收集59℃时的馏分;
(6)根据题给信息,溴和碳酸钠反应生成了溴化钠和溴酸钠,据此写出反应方程式为:Br2+Na2CO3→NaBr+NaBrO3,根据化合价升降总数相等配平为:3Br2+3Na2CO3→5NaBr+NaBrO3,根据原子守恒,还有产物二氧化碳3mol,故反应方程式为:3Br2+3Na2CO3=5NaBr+NaBrO3+3CO2↑,
故答案为:3Br2+3Na2CO3=5NaBr+NaBrO3+3CO2↑.
点评 本题结合海水提取溴的过程,考查了实验基本操作、实验方案的评价、氧化还原反应方程式的书写,题目难度中等,在配平时抓住化合价升降总数相等.


 精英口算卡系列答案
精英口算卡系列答案科目:高中化学 来源: 题型:解答题
 氮及其化合物在工农业生产生活中应用广泛,请解决下列问题.
氮及其化合物在工农业生产生活中应用广泛,请解决下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{ω}{5}$ g•mol-1 | B. | 2ωg | C. | 2ω g•mol-1 | D. | 4ω g•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①③ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烷光照下能与浓盐酸发生取代反应 | |
| B. | 乙烯可以用作生产食品包装材料的原料 | |
| C. | 乙醇室温下在水中的溶解度大于溴乙烷 | |
| D. | 乙酸和甲酸甲酯互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgNO3+NaCl═AgCl↓+NaNO3 | B. | 2F2+2H2O═4HF+O2 | ||
| C. | MgCl2(熔融)$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑ | D. | 3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 25.00 | 0.40 | 20.38 |
| 第二次 | 25.00 | 4.00 | 24.02 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com