


科目:高中化学 来源: 题型:
| A、1.2mol/L |
| B、2 mol/L |
| C、0.2 mol/L |
| D、0.4mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
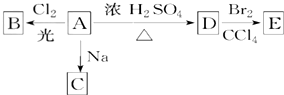
查看答案和解析>>
科目:高中化学 来源: 题型:
 Ⅰ、对于反应CO(g)+H2O(g)?H2(g)+CO2(g)
Ⅰ、对于反应CO(g)+H2O(g)?H2(g)+CO2(g)| 温度/℃ | 400 | 500 | 830 |
| 平衡常数K | 10 | 9 | 1 |
| 实验编号 | n(CO) | n(H2O) | n(H2) | n(CO2) |
| A | 1 | 5 | 2 | 3 |
| B | 2 | 2 | 1 | 1 |
| C | 0.5 | 2 | 1 | 1 |
2- 7 |
2- 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 太阳能电池是通过光电效应或者光化学效应直接把光能转化成电能的装置.其材料除单晶硅,还有铜铟镓硒等化合物.
太阳能电池是通过光电效应或者光化学效应直接把光能转化成电能的装置.其材料除单晶硅,还有铜铟镓硒等化合物.查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、化合物电离出的阳离子有氢离子的就是酸 | ||
| B、化合物电离出的阴离子有氢氧根离子的就是碱 | ||
| C、盐电离出的阳离子不一定都是金属阳离子 | ||
D、NH4Cl电离的电离方程式是NH4Cl═NH
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com