
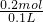 =2mol/L,
=2mol/L, c(H+)=
c(H+)= ×2mol/L=1mol/L,故10mL原硫酸溶液中n(SO42-)=0.01L×1mol/L=0.01mol,由反应Ba2++SO42-=BaSO4↓可知,生成BaSO4的物质的量为0.01mol,故硫酸钡的质量为0.01mol×233g/mol=2.33g,
×2mol/L=1mol/L,故10mL原硫酸溶液中n(SO42-)=0.01L×1mol/L=0.01mol,由反应Ba2++SO42-=BaSO4↓可知,生成BaSO4的物质的量为0.01mol,故硫酸钡的质量为0.01mol×233g/mol=2.33g, 计算原硫酸溶液中H+的物质的量浓度;
计算原硫酸溶液中H+的物质的量浓度; c(H+),根据n=cV计算n(SO42-),硫酸与氯化钡发生反应Ba2++SO42-=BaSO4↓,据此计算BaSO4的物质的量,根据m=nM计算BaSO4的质量.
c(H+),根据n=cV计算n(SO42-),硫酸与氯化钡发生反应Ba2++SO42-=BaSO4↓,据此计算BaSO4的物质的量,根据m=nM计算BaSO4的质量.

科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:2012-2013学年福建省漳州市东山二中高一(上)期中化学试卷(解析版) 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com