
分析 (1)A、橡胶硫化所用到的为单质硫;
B、烷基苯磺酸钠中含有磺酸基,制取过程中需要发生磺化反应;
C、铅蓄电池中需要用到硫酸和硫酸铅;
D、过磷酸钙的制取过程中需要浓硫酸和磷矿石;
(2)充分利用能量,应安装热交换器,吸引塔中填充许多瓷管,增大三氧化硫与浓硫酸的接触面;
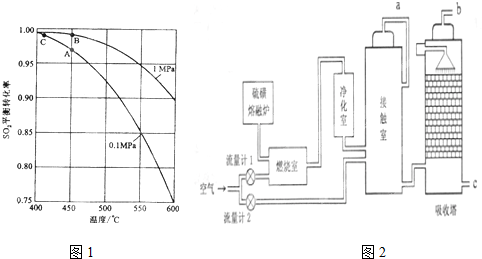
(3)从温度、压强对SO2的转化率进行分析;
(4)假设SO2的体积为x,经流量计1通入燃烧室的氧气过量50%,则流量计1中通入氧气的体积为1.5x,经流量计2的氧气量为接触室中SO2完全氧化时理论需氧量的2.5倍,则流量计2中通入氧气的体积为2.5×0.5x=1.25x,则流量计1中通入空气的体积为7.5x,流量计2中通入空气的体积为6.25x;燃烧室剩余空气6.5x,接触室剩余空气6.25x-0.5×0.95x=5.775x,剩余SO20.05x,故b管尾气中SO2的体积分数=$\frac{V(S{O}_{2})}{V(总)}$;
(5)二氧化硫是酸性氧化物,可用碱性物质氨水来处理.
解答 解:(1)A、橡胶硫化所用到的为单质硫,故A错误;
B、烷基苯磺酸钠中含有磺酸基,制取过程中需要发生磺化反应,磺化反应就是与硫酸发生的取代反应,故B正确;
C、铅蓄电池中需要用到硫酸作电解质溶液,故C正确;
D、过磷酸钙的制取过程中需要浓硫酸和磷矿石,故D正确;
故选:BCD;
(2)充分利用能量,应安装热交换器,吸引塔中填充许多瓷管,增大三氧化硫与浓硫酸的接触面,有利于三氧化硫的吸收,
故答案为:热交换器;增大三氧化硫与浓硫酸的接触面,有利于三氧化硫的吸收;
(3)由图2可知,不选B点,压强越大对设备的投资越大,消耗的动能大,SO2的转化率在1个大气压时,已经很高了,再提高压强SO2的转化率提高不大;不选C点,因为C点温度低,SO2的转化率虽然很高,但是催化剂的催化效率降低,450℃时催化剂的催化效率最高,所以选择A点,不选择C点;
故答案为:不选B点,压强越大对设备的投资越大,消耗的动能大,SO2的转化率在1个大气压时,已经很高了,再提高压强SO2的转化率提高不大;不选C点,因为C点温度低,SO2的转化率虽然很高,但是催化剂的催化效率降低,450℃时催化剂的催化效率最高,所以选择A点,不选择C点;
(4)燃烧室中的反应为S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2,假设SO2的体积为x,则流量计1中通入氧气的体积为1.5x,接触室中的反应为2SO2+O2?2SO3,则流量计2中通入氧气的体积为2.5×0.5x=1.25x;流量计1中通入空气的体积为7.5x,流量计2中通入空气的体积为6.25x,故流经流量计1和流量计2的空气体积比应为7.5x:6.25x=6:5;
燃烧室剩余空气6.5x,接触室剩余空气6.25x-0.5×0.95x=5.775x,剩余SO20.05x,故b管尾气中SO2的体积分数为$\frac{0.05x}{6.5x+5.775x+0.05x}$=0.41%;
故答案为:6:5;0.41%;
(5)硫酸工业的尾气中含有二氧化硫,二氧化硫是酸性氧化物,可用碱性物质氨水来处理,故答案为:用氨水吸收.
点评 本题考查化学与技术及工业生产,为往年高考热点,近几年高考一般不涉及,需要学生细读生产工艺图中各物质的变化进行解答,把握氨碱法、制备浓硫酸的工艺流程及设备的作用、发生的化学反应为解答的关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
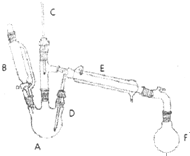 溴乙烷是有机合成的重要原料,实验室合成溴乙烷的装置示意图、相关原理和数据如下:
溴乙烷是有机合成的重要原料,实验室合成溴乙烷的装置示意图、相关原理和数据如下:| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 溶解度 | |
| 乙醇 | 46 | 0.789 | 78.3 | 易溶 |
| 溴乙烷 | 109 | 1.46 | 38.2 | 难溶 |
| 浓硫酸(H2SO4) | 98 | 1.84 | 338.0 | 易溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2O4(g)═2NO2(g),改变某一条件后,气体颜色加深 | |
| B. | H2(g)+I2(g)═2HI(g),单位时间内消耗H2和HI的物质的量之比大于1:2 | |
| C. | N2(g)+3H2(g)═2NH3(g),改变某一条件后,NH3的体积分数增加 | |
| D. | 2SO2(g)+O2(g)═2SO3(g),恒温恒压条件下,充入He |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 天然植物油常温下一般呈液态,难溶于水,没有恒定的熔点、沸点 | |
| B. | 乙醛、乙酸和葡萄糖都能与新制的Cu(OH)2反应,且反应类型均为氧化反应 | |
| C. | 乙醛、氯乙烯和乙二醇均可作为合成聚合物的单体 | |
| D. | 石油催化裂化的主要目的是提高汽油等轻质油的产量与质量;石油裂解的主要目的是得到更多的乙烯、丙烯等气态短链烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它们的原子核外电子层数随质子数的增加而增多 | |
| B. | 它们的L层电子数都相同 | |
| C. | 它们的原子核对最外层电子的引力逐渐减弱 | |
| D. | 它们与氧气或水反应时越来越剧烈 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K1=K2 | B. | K1<K2 | C. | K1>K2 | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
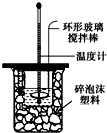 某实验小组用0.50mol/L NaOH溶液和0.50mol/L H2SO4溶液进行中和热的测定:
某实验小组用0.50mol/L NaOH溶液和0.50mol/L H2SO4溶液进行中和热的测定:| 名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 |  |  |  |  |  |  |
| 序号 | a | b | c | d | e | f |
| 实验次数 温度 | 起始温度t1/℃ | 终止温度t2/℃ | 平均温度差 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
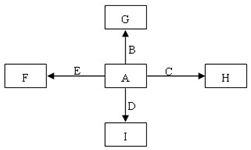 图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物.已知:①反应C+G$\stackrel{高温}{→}$B+H能放出大量的热,该反应曾应用于铁轨的焊接;
图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物.已知:①反应C+G$\stackrel{高温}{→}$B+H能放出大量的热,该反应曾应用于铁轨的焊接; ,它的空间构型是直线型;
,它的空间构型是直线型;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com