
| A. | 25℃时,由水电离出的c(H+)=1×10-12 mol•L-1的溶液中:Na+、NH4+、I-、NO3- | |
| B. | 能使酚酞变红的溶液中:K+、Na+、Cl-、CO32- | |
| C. | NaHCO3溶液中:K+、Na+、SO42-、Al3+ | |
| D. | 常温下,c(H+)/c(OH-)=1×1012的溶液中:Fe2+、Mg2+、Cl-、NO3- |
分析 A.25℃时,由水电离出的c(H+)=1×10-12 mol•L-1的溶液,为酸或碱溶液;
B.能使酚酞变红的溶液,显碱性;
C.离子之间相互促进水解;
D.常温下,c(H+)/c(OH-)=1×1012的溶液,显酸性.
解答 解:A.25℃时,由水电离出的c(H+)=1×10-12 mol•L-1的溶液,为酸或碱溶液,碱溶液中不能大量存在NH4+,酸溶液中I-、NO3-发生氧化还原反应,故A错误;
B.能使酚酞变红的溶液,显碱性,该组离子之间不反应,可大量共存,故B正确;
C.HCO3-、Al3+相互促进水解,不能共存,故C错误;
D.常温下,c(H+)/c(OH-)=1×1012的溶液,显酸性,Fe2+、H+、NO3-发生氧化还原反应,不能共存,故D错误;
故选B.
点评 本题考查离子共存,为高频考点,把握习题中的信息及常见离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子共存考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | c(H+)>c(OH-) | B. | c(NH4+)+c(NH3•H2O)=0.2 mol•L-1 | ||
| C. | c(NH3•H2O)>c(NH4+) | D. | c(NH4+)+c(H+)=0.2 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸碱滴定管装标准溶液前,必须先用该溶液润洗 | |
| B. | 滴定过程中眼睛应注视滴定管内液面变化 | |
| C. | 锥形瓶用蒸馏水洗涤后直接盛放待测液,对滴定结果无影响 | |
| D. | 用50mL酸式滴定管可准确量取25.00LHCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
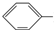 X+CH2=CH-M$→_{碱}^{Pb}$
X+CH2=CH-M$→_{碱}^{Pb}$ CH═CH-M+HX(X为卤原子,M为烃基或含酯基的取代基等)
CH═CH-M+HX(X为卤原子,M为烃基或含酯基的取代基等)
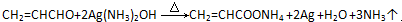 .
. .
.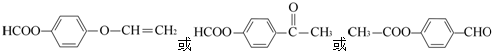 .
. )常用作香豆素的替代品,鉴别二氢香豆素和它的一种同分异构体(
)常用作香豆素的替代品,鉴别二氢香豆素和它的一种同分异构体(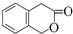 )需要用到的试剂有:NaOH溶液、稀硫酸、氯化铁溶液,
)需要用到的试剂有:NaOH溶液、稀硫酸、氯化铁溶液,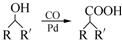 (R,R′为烃基),试写出以苯和丙烯(CH2=CH-CH3)为原料,合成
(R,R′为烃基),试写出以苯和丙烯(CH2=CH-CH3)为原料,合成 的路线流程图(无机试剂任选).合成路线流程图示例如下:H2C=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{Na_{3}CH_{2}Br溶液}$CH3CH2OH.
的路线流程图(无机试剂任选).合成路线流程图示例如下:H2C=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{Na_{3}CH_{2}Br溶液}$CH3CH2OH.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol•L-1的醋酸溶液的c(H+)约为0.01 mol•L-1 | |
| B. | 醋酸能与NaHCO3溶液反应放出CO2 | |
| C. | 醋酸的导电性比盐酸溶液的弱 | |
| D. | 10 mL 1 mol•L-1醋酸恰好与10 mL1 mol•L-1NaOH溶液完全反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
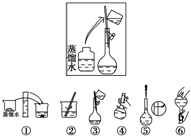 某同学帮助水质检测站配制500mL 0.5mol•L-1NaOH溶液以备使用.其操作步骤如图所示,则方框中操作的位置为( )
某同学帮助水质检测站配制500mL 0.5mol•L-1NaOH溶液以备使用.其操作步骤如图所示,则方框中操作的位置为( )| A. | ①与②之间 | B. | ②与③之间 | C. | ④与⑤之间 | D. | ⑤与⑥之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
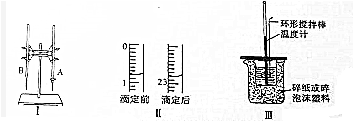
| 编号 | 待测盐酸的体积(ml) | 滴定前KOH溶液的体积(ml) | 滴定后KOH溶液的体积(ml) |
| 1 | 20.0 | 1.20 | 23.22 |
| 2 | 20.0 | 0.25 | 24.25 |
| 3 | 20.0 | 1.50 | 23.48 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com