
含有a mol FeBr2的溶液中,通入x mol Cl2。下列各项为通Cl2过程中,溶液内发生反应的离子方程式,其中不正确的是
A.x=0.4a,2Fe2++Cl2=2Fe3++2Cl-
B.x=0.6a,2Br-+Cl2=Br2+2Cl-
C.x=a,2Fe2++2Br-+2Cl2=Br2+2Fe3++4Cl-
D.x=1.5a,2Fe2++4Br-+3Cl2=2Br2++2Fe3++6Cl-
 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源:2014高考名师推荐化学热化学方程式的正误判断及书写(解析版) 题型:选择题
已知:①101 kPa时,2C(s)+O2(g)===2CO(g) ΔH=-221 kJ/mol;
②稀溶液中,H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ/mol。
下列结论正确的是
A.碳的燃烧热大于110.5 kJ/mol
B.①的反应热为221 kJ/mol
C.浓硫酸与稀NaOH溶液反应的中和热为-57.3 kJ/mol
D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学氮气、氧化物及硝酸(解析版) 题型:选择题
下列说法不正确的是
A.新制氯水可使蓝色石蕊试纸先变红后褪色
B.浓硝酸在光照下发黄,说明浓硝酸不稳定
C.SO2、NO2分别与水发生的反应均为氧化还原反应
D.水泥、普通玻璃、陶瓷等都是传统的硅酸盐制品
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学氧化还原规律(解析版) 题型:选择题
反应①、②分别是从海藻灰和某种矿石中提取碘的主要反应:
①2NaI+MnO2+3H2SO4=2NaHSO4+MnSO4+2H2O+I2
②2NaIO3+5NaHSO3=2Na2SO4+3NaHSO4+H2O+I2
下列说法正确的是
A.两个反应中均为硫元素被氧化
B.碘元素在反应①中被还原,在反应②中被氧化
C.氧化性:MnO2>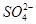 >
>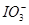 >I2
>I2
D.反应①、②中生成等量的I2时转移电子数比为1∶5
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学氧化还原概念(解析版) 题型:选择题
已知常温下在溶液中可发生如下两个离子反应:
Ce4++Fe2+=Fe3++Ce3+
Sn2++2Fe3+=2Fe2++Sn4+
由此可以确定Fe2+、Ce3+、Sn2+三种离子的还原性由强到弱的顺序是
A.Sn2+、Fe2+、Ce3+ B.Sn2+、Ce3+、Fe2+
C.Ce3+、Fe2+、Sn2+ D.Fe2+、Sn2+、Ce3+
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学氧化还原反应方程式的配平及相关计算(解析版) 题型:填空题
(1)请将下列五种物质:KBr、Br2、I2、KI、K2SO4分别填入下列横线上,组成一个未配平的化学方程式:
KBrO3+ +H2SO4—→ + + + +H2O。
(2)如果该化学方程式中I2和KBr的化学计量数分别是8和1,则①Br2的化学计量数是 ;
②请将反应物的化学式及配平后的化学计量数填入下列相应的位置中:
KBrO3+ + H2SO4—→……;
③若转移10 mol电子,则反应后生成I2的物质的量为 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学氧化还原反应方程式的配平及相关计算(解析版) 题型:选择题
一定质量的某铁的氧化物FexOy,与足量4 mol/L稀硝酸溶液充分反应,消耗硝酸700 mL,放出2.24 L NO气体(标准状况)。则该铁的氧化物的化学式为
A.FeO B.Fe2O3 C.Fe3O4 D.Fe8O10
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学气体制备(解析版) 题型:实验题
利用酸解法制钛白粉产生的废液[含有大量FeSO4、H2SO4和少量Fe2(SO4)3TiOSO4],生产硫酸亚铁和补血剂乳酸亚铁。其生产步骤如下:

请回答:
(1)步骤①中分离操作的名称是______;步骤⑥必须控制一定的真空度,原因是_________;
(2)废液中的TiOSO4在步骤①能水解生成滤渣(主要成分为TiO2?xH2O)的化学方程式为__________;步骤④的离子方程式为_____________________。
(3)用平衡移动原理解释步骤⑤中加乳酸能得到乳酸亚铁的原因_______。
(4)配平酸性高锰酸钾溶液与硫酸亚铁溶液反应的离子方程式:_____Fe2++_____MnO4-+_____H+=_____Fe3++_____Mn2++_____
取步骤②所得晶体样品ag,溶于稀硫酸配成100.00 mL溶液,取出20. 00 mL溶液,用KMnO4溶液滴定(杂质与KMnO4不反应)。若消耗0.1000 mol·L-1KMnO4溶液20.00mL,则所得晶体中FeSO4?7H2O的质量分数为(以含a的式子表示)_____________________。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学探究组成、性质的实验方案的设计与评价(解析版) 题型:填空题
为研究铁质材料与热浓硫酸的反应,某学习小组用碳素钢(即铁和碳的合金)进行了以下探究活动:
[探究一](1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是 。
(2)称取碳素钢6.0 g放入15.0 mL浓硫酸中,加热,充分反应后得到溶液X并收集到混合气体Y。
①甲同学认为X中除Fe3+之外还可能含有Fe2+。若要确认其中的Fe2+,应选用 (选填序号)。
A.KSCN溶液和氯水 B.铁粉和KSCN溶液
C.浓氨水 D.酸性KMnO4溶液
②乙同学取560 mL(标准状况)气体Y通入足量溴水中,发生SO2+Br2+2H2O=2HBr+H2SO4反应,然后加入足量BaCl2溶液,经适当操作后得干燥固体4.66 g。由此推知气体Y中SO2的体积分数为 。
[探究二]根据上述实验中SO2体积分数的分析,丙同学认为气体Y中还可能含有Q1和Q2两种气体,其中Q1气体,在标准状况下,密度为0.0893 g·L-1。为此设计了下列探究实验装置(假设有关气体完全反应)。

(3)装置B中试剂的作用是 。
(4)分析Y气体中的Q2气体是如何生成的 (用化学方程式表示)。
(5)已知洗气瓶M中盛装澄清石灰水,为确认Q2的存在,需在装置中添加洗气瓶M于 (填序号)。
A.A之前 B.A—B间
C.B—C间 D.C—D间
(6)如果气体Y中含有Q1,预计实验现象应是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com