
烟气脱硫能有效减少二氧化硫的排放。实验室用粉煤灰(主要含Al2O3、SiO2等)制备碱式硫酸铝[Al2(SO4)x(OH)6-2x]溶液,并用于烟气脱硫研究。

(1)酸浸时反应的化学方程式为____________________;滤渣Ⅰ的主要成分为________(填化学式)。
(2)加CaCO3调节溶液的pH至3.6,其目的是中和溶液中的酸,并使Al2(SO4)3转化为Al2(SO4)x(OH)6-2x。滤渣Ⅱ的主要成分为________(填化学式);若溶液的pH偏高,将会导致溶液中铝元素的含量降低,其原因是__________________________(用离子方程式表示)。
(3)上述流程中经完全热分解放出的SO2量总是小于吸收的SO2量,其主要原因是________________________;与吸收SO2前的溶液相比,热分解后循环利用的溶液的pH将________(填“增大”“减小”或“不变”)。
(1)Al2O3+3H2SO4===Al2(SO4)3+3H2O SiO2
(2)CaSO4 3CaCO3+2Al3++3SO +3H2O===2Al(OH)3+3CaSO4+3CO2↑
+3H2O===2Al(OH)3+3CaSO4+3CO2↑
(3)溶液中的部分SO 被氧化成SO
被氧化成SO 减小
减小
[解析] (1)粉煤灰中的Al2O3能与H2SO4反应生成Al2(SO4)3,而SiO2不能与H2SO4反应,因而滤渣Ⅰ为SiO2。(2)滤液为Al2(SO4)3,与CaCO3反应生成微溶物CaSO4,因而滤渣Ⅱ为CaSO4。溶液中存在Al3++3H2OAl(OH)3+3H+,CaCO3+2H+=== Ca2++H2O+CO2↑,溶液的pH偏高,碱性增强,会促进Al3+水解,铝元素容易转化为Al(OH)3沉淀而导致溶液中铝元素含量降低。(3)+4价S具有较强还原性,溶液中的SO 容易被氧化为SO
容易被氧化为SO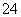 。SO2在水中溶解度较大且SO2溶于水生成H2SO3,且加热时部分H2SO3会被氧化为酸性更强的H2SO4,因而比吸收SO2前酸性增强,pH减小。
。SO2在水中溶解度较大且SO2溶于水生成H2SO3,且加热时部分H2SO3会被氧化为酸性更强的H2SO4,因而比吸收SO2前酸性增强,pH减小。


科目:高中化学 来源: 题型:
将露置于空气中的某氢氧化钠固体样品溶于水,向所得溶液中逐滴加入稀盐酸至过量,生成的CO2体积(标准状况)与加入的盐酸体积有如图关系(不考虑CO2在水中的溶解)。试计算:(无需书写计算步骤)
(1)盐酸的物质的量浓度为 mol/L。
(2)该样品中NaOH与Na2CO3物质的量之比为 。

查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏伽德罗常数的值,下列说法正确的是( )
A.1 mol OH- 中含有9NA个电子
B. 28 g CO气体中含有NA个氧原子
C.1 L 1 mol/L AlCl3溶液中含有NA个Al3+
D.常温常压下,11.2 L甲烷气体中含有的分子数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述错误的是( )
A.SO2使溴水褪色与乙烯使KMnO4溶液褪色的原理相同
B.制备乙酸乙酯时可用热的NaOH溶液收集产物以除去其中的乙酸
C.用饱和食盐水替代水跟电石反应,可以减缓乙炔的产生速率
D.用AgNO3溶液可以鉴别KCl和KI
查看答案和解析>>
科目:高中化学 来源: 题型:
焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:
实验一 焦亚硫酸钠的制取
采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置Ⅱ中有Na2S2O5晶体析出,发生的反应为Na2SO3+SO2===Na2S2O5。
(1)装置Ⅰ中产生气体的化学方程式为______________________________________。
(2)要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是______。
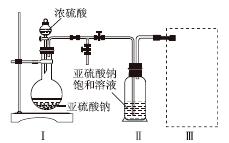
(3)装置Ⅲ用于处理尾气,可选用的最合理装置(夹持仪器已略去)为________(填序号)。
实验二 焦亚硫酸钠的性质
Na2S2O5溶于水即生成NaHSO3。
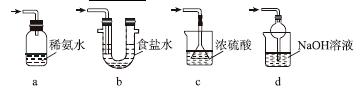
(4)证明NaHSO3溶液中HSO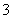 的电离程度大于水解程度,可采用的实验方法是________(填序号)。
的电离程度大于水解程度,可采用的实验方法是________(填序号)。
a.测定溶液的pH b.加入Ba(OH)2溶液
c.加入盐酸 d.加入品红溶液
e.用蓝色石蕊试纸检测
(5)检测Na2S2O5晶体在空气中已被氧化的实验方案是
________________________________________________________________________
________________________________________________________________________。
实验三 葡萄酒中抗氧化剂残留量的测定
(6)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

(已知:滴定时反应的化学方程式为SO2+I2+2H2O===H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为________g·L-1。
②在上述实验过程中,若有部分HI被空气氧化,则测定结果________(填“偏高”“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于材料的说法不正确的是( )
A.太阳能电池板中的硅在元素周期表中处于金属与非金属的交界位置
B.二氧化硅可用作光导纤维
C.石英玻璃耐强酸强碱,可用来制造化学仪器
D.Si3N4是一种新型无机非金属材料,可用于制造发动机
查看答案和解析>>
科目:高中化学 来源: 题型:
在容积为1.00 L的容器中,通入一定量的N2O4,发生反应N2O4(g) 2NO2(g),随温度升高,混合气体的颜色变深。
2NO2(g),随温度升高,混合气体的颜色变深。
回答下列问题:
(1)反应的ΔH________0(填“大于”或“小于”);100 ℃时,体系中各物质浓度随时间变化如图所示。在0~60 s时段,反应速率v(N2O4)为________mol·L-1·s-1;反应的平衡常数K1为________。
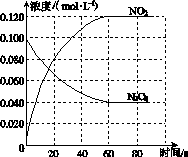
(2)100 ℃时达平衡后,改变反应温度为T,c(N2O4)以0.002 0 mol·L-1·s-1的平均速率降低,经10 s又达到平衡。
①T________100 ℃(填“大于”或“小于”),判断理由是____________________________。
②列式计算温度T时反应的平衡常数K2:_______________________________________
________________________________________________________________________。
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向________(填“正反应”或“逆反应”)方向移动,判断理由是__________________________________________________
________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com