
【题目】已知C(s)+O2(g)=CO2(g)△H1=﹣393.5kJ/mol, 2CO(g)+O2(g)=2CO2(g)△H2=﹣566.0kJ/mol,
C(s)+0.5O2(g)=CO(g)△H3=akJ/mol,则a= .
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】甲醇是重要的工业原料.煤化工可以利用煤炭制取水煤气从而合成甲醇:CO(g)+2H2(g)CH3OH(g).已知常温常压下反应的能量变化如图1所示: 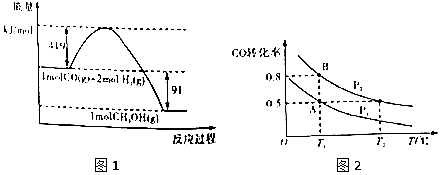 ②
②
化学键 | H﹣H | H﹣O | O=O |
键能kj/mol | 436 | x | 496 |
③CO(g)+ ![]() O2(g)=CO2(g)△H=﹣280kJ/mol
O2(g)=CO2(g)△H=﹣280kJ/mol
H2(g)+ ![]() O2(g)=H2O(I)△H=﹣284kJ/mol
O2(g)=H2O(I)△H=﹣284kJ/mol
H2O(I)=H2O(g)△H=+44kJ/mol
请回答下列问题:
(1)甲醇气体分解为CO和H2两种气体这一反应的活化能为kj/mol;
(2)请写出表示气态甲醇燃烧热的热化学方程式;
(3)H﹣O的键能x值为;
(4)如图2:在一容积可变的密闭容器中充入10molCO气体和30molH2气体,当达到平衡状态A时,容器的体积为20L.如反应开始时仍充入10molCO和30molH2 , 则在平衡状态B时容器的体积V(B)=L;
(5)在甲、乙、丙三个不同密闭容器中按不同方式投料,一定条件下发生该反应(起始温度和起始体积相同,反应物和生成物反应前后均为气态).相关数据如表所示:
容器 | 甲 | 乙 | 丙 |
相关条件 | 恒温恒容 | 绝热恒容 | 恒温恒压 |
反应物投料 | 1molCO、2molH2 | 1molCH3OH | 1molCH3OH |
平衡时容器体积 | V(甲) | V(乙) | V(丙) |
反应的平衡常数K | K(甲) | K(乙) | K(丙) |
平衡时CH3OH的浓度/molL﹣1 | C(甲) | C(乙) | C(丙) |
平衡时CH3OH的反应速率/molL﹣1min﹣1 | v(甲) | v(乙) | v(丙) |
则下列说法正确的是 .
A.V(甲)>V(丙)
B.K(乙)>K(丙)
C.c(乙)>c(甲)
D.v(甲)=v(丙)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质溶于水电离出的Cl-数目,与2mol NaCl溶于水电离出的Cl- 数目相同的是( )。
A. 1mol MgCl2 B. 2mol KClO3 C. 1mol AlCl3 D. 1.5mol CaCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物A,含有Al2(SO4)3、Al2O3和Fe2O3,在一定条件下可实现下图所示的变化。

请回答下列问题。
(1)图中涉及分离溶液与沉淀的方法是__________________。
(2)B、C、D、E 4种物质的化学式为:B_________、C_________、D_________、E_________。
(3)沉淀F与NaOH溶液反应的离子方程式为__________________________________。沉淀E与稀硫酸反应的离子方程式为__________________________________________。溶液G与过量稀氨水反应的化学方程式为______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M、R、X、Y为原子序数依次增大的短周期主族元素,Z是一种过渡元素.M基态原子L层中p轨道电子数是s电子数的2倍,R是同周期元素中最活泼的金属元素,X和M形成的一种化合物是引起酸雨的主要大气污染物,Z的基态原子4s和3d轨道半充满.请回答下列问题:
(1)R基态原子的电子排布式是 , X和Y中电负性较大的是(填元素符号).
(2)X的氢化物的沸点低于与其组成相似的M的氢化物,其原因是 .
(3)X与M形成的XM3分子的空间构型是 .
(4)M和R所形成的一种离子化合物R2M晶体的晶胞如图所示,则图中黑球代表的离子是(填离子符号).
(5)在稀硫酸中,Z的最高价含氧酸的钾盐(橙色)氧化M的一种氢化物,Z被还原为+3价,该反应的化学方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某一容积为5L的密闭容器内,加入 0.2mol的CO和0.2mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H2O(g)CO2(g)+H2(g);△H>0反应中CO2的浓度随时间变化情况如下图: 
(1)根据上图数据,反应开始至达到平衡时,CO2的化学反应速率为v(CO2)=mol/(Lmin);反应达平衡时,c(H2O)=mol/L,该温度下的平衡常数K= .
(2)判断该反应达到平衡的依据是 . ①正、逆反应速率都为零
②CO减少的化学反应速率和CO2减少的化学反应速率相等
③CO、H2O、CO2、H2的浓度都相等
④CO、H2O、CO2、H2的浓度都不再发生变化
(3)如要一开始加入0.1mol的CO、0.1mol的H2O、0.1mol的CO2和0.1mol的H2 , 在相同的条件下,反应达平衡时,c(H2)=mol/L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】观察下列实验装置图,试回答下列问题:

(1)写出图中四种实验操作的名称依次是 ______ 、 ______ 、 ______ 、 ______ 。
(2)写出装置④中所用玻璃仪器的名称 ______ 、 ______ 。
(3)下列实验需要在哪套装置中进行(填序号):
a、从海水中提取蒸馏水: ______ ; b、分离氯化钠和水: ______ ;
c、分离碳酸钙和水: ______ ; d、分离植物油和水: ______ ;
(4)装置②中玻璃棒的作用是__________________________________;
(5)装置 ③中冷却水低进高出的原因是_________________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 共价化合物一定不含离子键
B. 离子化合物一定不含共价键
C. 气态单质的分子中一定存在共价键
D. 全部由非金属元素形成的化合物一定不含离子键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com