
”¾ĢāÄæ”æA”¢B”¢C”¢DŹĒ°“Ō×ÓŠņŹżÓÉŠ”µ½“óÅÅĮŠµÄµŚ¶ž”¢ČżÖÜĘŚŌŖĖŲµÄµ„ÖŹ”£B”¢E¾łĪŖ×é³ÉæÕĘųµÄ³É·Ö”£»ÆŗĻĪļFµÄŃęÉ«·“Ó¦³Ź»ĘÉ«”£ŌŚGÖŠ£¬·Ē½šŹōŌŖĖŲÓė½šŹōŌŖĖŲµÄŌ×ÓøöŹż±ČĪŖ1”Ć2”£ŌŚŅ»¶ØĢõ¼žĻĀ£¬ø÷ĪļÖŹÖ®¼äµÄĻą»„×Ŗ»Æ¹ŲĻµČēĻĀĶ¼(Ķ¼ÖŠ²æ·Ö²śĪļĪ“ĮŠ³ö)£ŗ

ĒėĢīŠ“ĻĀĮŠæÕ°×£ŗ
£Ø1£©AŗĶC·Ö±šŹĒ_______________”£
£Ø2£©HÓėŃĪĖį·“Ӧɜ³ÉEµÄ»Æѧ·½³ĢŹ½ŹĒ_____________________________________________”£
£Ø3£©EÓėF·“Ó¦µÄ»Æѧ·½³ĢŹ½ŹĒ_____________________________________________________”£
£Ø4£©FÓėĖ®·“Ó¦µÄĄė×Ó·½³ĢŹ½ŹĒ____________________________________________________”£
£Ø5£©ĪļÖŹEµÄ½į¹¹Ź½ĪŖ£ŗ_____________£»ĪļÖŹA-HÖŠŹōÓŚĄė×Ó»ÆŗĻĪļŹĒ£ŗ_____________”£
”¾“š°ø”æ Ģ¼”¢ÄĘ Na2CO3 + 2HCl£½2NaCl + H2O + CO2”ü 2Na2O2 + 2CO2£½2Na2CO3 + O2 2Na2O2 + 2H2O£½4Na+ +4OH- + O2”ü O=C=O Na2O2 ”¢Na2S ”¢Na2CO3
”¾½āĪö”æA”¢B”¢C”¢DŹĒ°“Ō×ÓŠņŹżÓÉŠ”µ½“óÅÅĮŠµÄµŚ¶ž”¢ČżÖÜĘŚŌŖĖŲµÄµ„ÖŹ£¬B”¢E¾łĪŖ×é³ÉæÕĘųµÄ³É·Ö£¬µ„ÖŹBÓėC·“Ó¦µĆµ½F£¬FµÄŃęÉ«·“Ó¦³Ź»ĘÉ«£¬ĖµĆ÷FŹĒÄʵĻÆŗĻĪļ£¬¹ŹCĪŖNa£¬æ¼ĀĒBĪŖO2£¬EŹĒCO2£¬ŌņFĪŖNa2O2£¬HŹĒNa2CO3£¬AĪŖĢ¼£¬GŹĒµ„ÖŹC”¢D»ÆŗĻ¶ų³É£¬Ō×ÓøöŹż±ČĪŖD£ŗC=1£ŗ2£¬ŌņGÖŠDŌŖĖŲĪŖ-2¼Ū£¬ĒŅŌ×ÓŠņŹżD£¾C£¬¹ŹDĪŖĮņ£¬GĪŖNa2S”£Ōņ
£Ø1£©ÓÉŅŌÉĻ·ÖĪöæÉÖŖ£¬AĪŖĢ¼£¬CĪŖ½šŹōÄĘ£»£Ø2£©HŹĒNa2CO3£¬ÓėŃĪĖį·“Ӧɜ³É¶žŃõ»ÆĢ¼ŗĶĖ®£¬·“Ó¦µÄ·½³ĢŹ½ĪŖNa2CO3+2HCl£½2NaCl+H2O+CO2”ü£»£Ø3£©EÓėF·“Ó¦ĪŖCO2ŗĶNa2O2µÄ·“Ó¦£¬Éś³ÉĢ¼ĖįÄĘŗĶŃõĘų£¬·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ2CO2+2Na2O2£½2Na2CO3+O2£»£Ø4£©¹żŃõ»ÆÄĘÓėĖ®·“Ӧɜ³ÉĒāŃõ»ÆŗĶŃõĘų£¬·½³ĢŹ½ĪŖ2Na2O2+2H2O£½4Na++4OH- +O2”ü£»£Ø5£©¶žŃõ»ÆĢ¼µÄ½į¹¹¼ņŹ½ĪŖO=C=O£¬ŗ¬ÓŠĄė×Ó¼üµÄ»ÆŗĻĪļŹĒĄė×Ó»ÆŗĻĪļ£¬ŌņŹōÓŚĄė×Ó»ÆŗĻĪļµÄŹĒNa2O2 ”¢Na2S ”¢Na2CO3”£


 ĆūŠ£æĪĢĆĻµĮŠ“š°ø
ĆūŠ£æĪĢĆĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŹµŃéŹŅÅäÖĘ500mLÅضČĪŖ2mol/LµÄNaOHČÜŅŗ£®Ń”ÓĆČŻĮæĘæµÄ¹ęøńŗĶĖłŠčNaOHµÄÖŹĮæ·Ö±šĪŖ£Ø””””£©
A.100 mL ČŻĮæĘ攢40 g
B.500 mL ČŻĮæĘ攢40 g
C.100 mL ČŻĮæĘ攢80 g
D.500 mL ČŻĮæĘ攢80 g
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æµŖ¼°Ęä»ÆŗĻĪļŌŚÉś»īŗĶÉś²śÖŠÓ¦ÓĆ¹ć·ŗ”£
£Ø1£©øł¾Ż×īŠĀ”°ČĖ¹¤¹ĢµŖ”±µÄŃŠ¾æ±ØµĄ£¬ŌŚ³£ĪĀ”¢³£Ń¹”¢¹āÕÕĢõ¼žĻĀ£¬N2ŌŚ“߻ƼĮ£Ø²ōÓŠÉŁĮæFe2O3ŗĶTiO2£©±ķĆęÓėĖ®·¢Éś·“Ó¦£ŗ2N2(g)£«6H2O£Ø1£©![]() 4NH3(g)£«3O2(g)
4NH3(g)£«3O2(g) ![]() H=£«1530 kJ”¤mol-1£¬ÓÖÖŖ£ŗH2O(g) = H2O£Ø1£©
H=£«1530 kJ”¤mol-1£¬ÓÖÖŖ£ŗH2O(g) = H2O£Ø1£© ![]() H=£44.0 kJ”¤mol-1£¬Ōņ4NH3(g)£«3O2(g)
H=£44.0 kJ”¤mol-1£¬Ōņ4NH3(g)£«3O2(g)![]() 2N2(g)£«6H2O(g)
2N2(g)£«6H2O(g) ![]() H =_____kJ”¤mol-1”£ŌŚŗćĪĀŗćČŻĆܱÕČŻĘ÷ÖŠ£¬µ±øĆ·“Ó¦“¦ÓŚĘ½ŗāדĢ¬Ź±£¬ÓūŹ¹Ę½ŗāĻņÕż·“Ó¦·½ĻņŅʶÆĒŅ·“Ó¦ĖŁĀŹ¼Óæģ£¬ĻĀĮŠ“ėŹ©æÉŠŠµÄŹĒ_____”££ØĢī×ÖÄø£©
H =_____kJ”¤mol-1”£ŌŚŗćĪĀŗćČŻĆܱÕČŻĘ÷ÖŠ£¬µ±øĆ·“Ó¦“¦ÓŚĘ½ŗāדĢ¬Ź±£¬ÓūŹ¹Ę½ŗāĻņÕż·“Ó¦·½ĻņŅʶÆĒŅ·“Ó¦ĖŁĀŹ¼Óæģ£¬ĻĀĮŠ“ėŹ©æÉŠŠµÄŹĒ_____”££ØĢī×ÖÄø£©
A£®ĻņĘ½ŗā»ģŗĻĪļÖŠ³äČėAr B£®ĻņĘ½ŗā»ģŗĻĪļÖŠ³äČėO2
C£®²ÉÓĆøüŗĆµÄ“ß»Æ¼Į D£®½µµĶ·“Ó¦µÄĪĀ¶Č
£Ø2£©¢ŁÓĆ°±ĘųÖĘČ”ÄņĖŲ[CO(NH2)]µÄ·“Ó¦ĪŖ£ŗ2NH3(g)£«CO2(g)![]() CO(NH2)2(s)£«H2O(g)”÷H£¼0£¬Ä³ĪĀ¶ČĻĀ£¬ĻņČŻĘ÷ĪŖ1LµÄĆܱÕČŻĘ÷ÖŠĶØČė4 mol NH3ŗĶ2molCO2£¬øĆ·“Ó¦½ųŠŠµ½40sŹ±£¬“ļµ½Ę½ŗā£¬“ĖŹ±CO2µÄ×Ŗ»ÆĀŹĪŖ50%”£ĻĀĶ¼ÖŠµÄĒśĻß±ķŹ¾ŌŚĒ°25sÄŚNH3µÄÅضČĖꏱ¼äµÄ±ä»Æ”£Čē¹ū±£³ÖĘäĖūĢõ¼ž²»±äµÄĒéæöĻĀŹ¹ÓĆ“ß»Æ¼Į£¬ĒėŌŚĻĀĶ¼ÖŠÓĆŹµĻß»³öc(NH3)Ėꏱ¼äµÄ±ä»ÆĒśĻß”£_______________”£
CO(NH2)2(s)£«H2O(g)”÷H£¼0£¬Ä³ĪĀ¶ČĻĀ£¬ĻņČŻĘ÷ĪŖ1LµÄĆܱÕČŻĘ÷ÖŠĶØČė4 mol NH3ŗĶ2molCO2£¬øĆ·“Ó¦½ųŠŠµ½40sŹ±£¬“ļµ½Ę½ŗā£¬“ĖŹ±CO2µÄ×Ŗ»ÆĀŹĪŖ50%”£ĻĀĶ¼ÖŠµÄĒśĻß±ķŹ¾ŌŚĒ°25sÄŚNH3µÄÅضČĖꏱ¼äµÄ±ä»Æ”£Čē¹ū±£³ÖĘäĖūĢõ¼ž²»±äµÄĒéæöĻĀŹ¹ÓĆ“ß»Æ¼Į£¬ĒėŌŚĻĀĶ¼ÖŠÓĆŹµĻß»³öc(NH3)Ėꏱ¼äµÄ±ä»ÆĒśĻß”£_______________”£
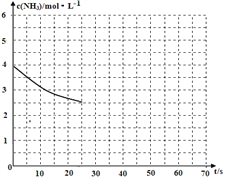
¢Ś Čō±£³ÖĪĀ¶ČŗĶČŻĘ÷Ģå»ż²»±ä£¬ĻņĘ½ŗāĢåĻµÖŠŌŁĶØČė2molNH3ŗĶ2molH2O£¬“ĖŹ±vÕż______vÄę£ØĢī”°>”±”¢”°=”±»ņ”°<”±£©
£Ø3£©µžµŖĖįÄĘ(NaN3)³£ÓĆÓŚĘū³µ°²Č«ĘųÄŅÖŠ£¬¹¤Ņµ Éś²śNaN3Ö÷ŅŖŹĒŌŚ175”ꏱ°ŃNaNO3·ŪÄ©¼Óµ½ČŪ»ÆµÄNaNH2ÖŠ£¬“ĖĶā»¹Éś³ÉĮ½ÖÖ³£¼ūµÄ¼īŠŌĪļÖŹ£¬ĒėŠ“³öÉĻŹö¹ż³ĢµÄ»Æѧ·½³ĢŹ½_______________________”£
£Ø4£©ōĒ°·NH2OHæÉŅŌæ“×÷ŹĒNH3·Ö×ÓÄŚµÄŅ»øöĒāŌ×Ó±»ōĒ»łČ”“śµÄŃÜÉśĪļ”£ŅŌĻõĖį”¢ĮņĖįĖ®ČÜŅŗ×÷µē½āÖŹ½ųŠŠµē½ā£¬ŌŚ¹Æµē¼«ÉĻNO3-æÉ×Ŗ»ÆĪŖNH2OH£¬ŅŌ²¬ĪŖĮķŅ»¼«£¬ŌņøƵē½ā·“Ó¦µÄ×Ü»Æѧ·½³ĢŹ½_______”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ¶ŌÓŚH2ŌŚO2ÖŠČ¼ÉÕ·“Ó¦µÄĆčŹö£¬ÕżČ·µÄŹĒ£Ø””””£©
A.øĆ·“Ó¦ŹōÓŚ·ÅČČ·“Ó¦
B.¶ĻæŖH©H¼ü·Å³öÄÜĮæ
C.ŠĪ³ÉO©H¼üĪüŹÕÄÜĮæ
D.·“Ó¦ŗóÉś³ÉĪļ×ÜÄÜĮæÉżøß
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”ææÉŌŁÉśÄÜŌ“ŗĶĒå½ąÄÜŌ“½«³ÉĪŖŠĀÄÜŌ“µÄÖ÷Į¦¾ü£¬ĻĀĮŠ¹ŲÓŚÄÜŌ“µÄŠšŹöÕżČ·µÄŹĒ
A.»ÆŹÆČ¼ĮĻŹĒæÉŌŁÉśÄÜŌ“B.ĒāÄÜ”¢Ģ«ŃōÄÜŹĒĒå½ąÄÜŌ“
C.»ÆŹÆČ¼ĮĻ¶¼ŹĒĒå½ąÄÜŌ“D.ŗ£ŃóÄÜ”¢µŲČČÄÜŹĒ²»æÉŌŁÉśµÄĒå½ąÄÜŌ“
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æX”¢Y”¢Z”¢M”¢Q”¢R½ŌĪŖĒ°20ŗÅŌŖĖŲ£¬ĘäŌ×Ó°ė¾¶ÓėÖ÷ŅŖ»ÆŗĻ¼ŪµÄ¹ŲĻµČēĶ¼ĖłŹ¾”£ĻĀĮŠĖµ·Ø“ķĪóŹĒ

A. QĪ»ÓŚµŚČżÖÜĘŚIA×å
B. X”¢Y”¢ZČżÖÖŌŖĖŲ×é³ÉµÄ»ÆŗĻĪļæÉÄÜŹĒŃĪ»ņ¼ī
C. ¼ņµ„Ąė×Ó°ė¾¶£ŗM->Q+>R2+
D. ZÓėMµÄ×īøß¼ŪŃõ»ÆĪļ¶ŌÓ¦Ė®»ÆĪļ¾łĪŖĒæĖį
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ½»ĶØŌĖŹä²æŌŚÄĻŗ£»ŖŃō½ø¾ŁŠŠ»ŖŃōµĘĖžŗĶ³ą¹ĻµĘĖžæ¢¹¤·¢¹āŅĒŹ½£¬Šū²¼Į½×ł“óŠĶ¶ą¹¦ÄܵĘĖžÕżŹ½·¢¹ā²¢Ķ¶ČėŹ¹ÓĆ”£Ć¾ŗ£Ė®µē³ŲæÉĪŖµĘĖžĢį¹©ÄÜŌ“£¬Ęä×°ÖĆČēĶ¼ĖłŹ¾”£ĻĀĮŠÓŠ¹ŲĆ¾ŗ£Ė®µē³ŲµÄĖµ·ØÕżČ·µÄŹĒ
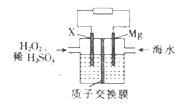
A. Mgµē¼«ÉĻ·¢Éś»¹Ō·“Ó¦
B. øƵē³Ų¹¤×÷Ņ»¶ĪŹ±¼äŗó£¬×ó²ąČÜŅŗÖŹĮæ¼õĒį
C. Õż¼«µÄµē¼«·“Ó¦Ź½ĪŖH2O2+2e-+2H+=2H2O
D. Čōµē³Ų¹¤×÷Ź±×ŖŅĘ2 molµē×Ó£¬ŌņÓŠ2 mol H+ÓÉÖŹ×Ó½»»»Ä¤×ó²ąĻņÓŅ²ąĒØŅĘ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æijæĪĶā»ī¶ÆŠ”×éĪŖĮĖ¼ģŃéÅØĮņĖįÓėľĢæŌŚ¼ÓČČĢõ¼žĻĀ·“Ó¦²śÉśµÄSO2ŗĶCO2ĘųĢ壬Éč¼ĘĮĖČēĶ¼ĖłŹ¾ŹµŃé×°ÖĆ£¬a”¢b”¢cĪŖÖ¹Ė®¼Š£¬BŹĒÓĆÓŚ“¢ĘųµÄĘųÄŅ£¬DÖŠ·ÅÓŠÓĆI2ŗĶµķ·ŪµÄĄ¶É«ČÜŅŗ½žŹŖµÄĶŃ֬Ǝ£® 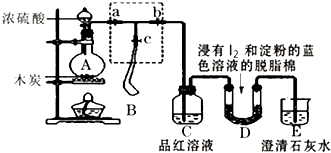
£Ø1£©×°ÖĆAÖŠŹ¢·ÅÅØĮņĖįµÄŅĒĘ÷Ćū³Ę £®
£Ø2£©×°ÖĆAÖŠ·¢Éś·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ £®
£Ø3£©ŹµŃ鏱£¬×°ÖĆCÖŠµÄĻÖĻóĪŖ £®
£Ø4£©“ĖŹµŃé³É°ÜµÄ¹Ų¼üŌŚÓŚæŲÖĘ·“Ó¦²śÉśĘųĢåµÄĖŁĀŹ²»Äܹżæģ£¬Ņņ“ĖÉč¼ĘĮĖŠéæņ²æ·ÖµÄ×°ÖĆ£¬ŌņÕżČ·µÄ²Ł×÷Ė³ŠņŹĒ£ØÓĆ²Ł×÷±ąŗÅĢīŠ“£©£® ¢ŁĻņA×°ÖĆÖŠ¼ÓČėÅØĮņĖį£¬¼ÓČČ£¬Ź¹AÖŠ²śÉśµÄĘųĢå½ųČėĘųÄŅB£¬µ±ĘųÄŅÖŠ³äČėŅ»¶ØĮæĘųĢåŹ±£¬Ķ£Ö¹¼ÓČČ£»
¢Ś“ż×°ÖĆAĄäČ“£¬ĒŅĘųÄŅBµÄĢå»ż²»ŌŁ±ä»Æŗ󣬹Ų±ÕÖ¹Ė®¼Ša£¬“ņæŖÖ¹Ė®¼Šb£¬ĀżĀż¼·Ń¹ĘųÄŅ£¬Ź¹ĘųÄŅBÖŠĘųĢåĀżĀż½ųČė×°ÖĆCÖŠ£¬“ż“ļµ½ŹµŃéÄæµÄŗ󣬹Ų±ÕÖ¹Ė®¼Šb£»
¢Ū“ņæŖÖ¹Ė®¼ŠaŗĶc£¬¹Ų±ÕÖ¹Ė®¼Šb£»
£Ø5£©µ±DÖŠ²śÉśĻÖĻóŹ±£¬æÉŅŌĖµĆ÷Ź¹EÖŠ³ĪĒåŹÆ»ŅĖ®±ä»ė×ĒµÄŹĒCO2 £¬ ¶ų²»ŹĒSO2£»Š“³öDÖŠ·¢Éś·“Ó¦µÄ»Æѧ·½³ĢŹ½ £¬ µ±DÖŠ·“Ó¦·¢Éś0.3molµē×Ó×ŖŅĘŹ±£¬·¢Éś·“Ó¦µÄĘųĢåµÄĢå»ż£Ø±ź×¼×“æö£©ŹĒL£®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÄÜÖ¤Ć÷µķ·ŪŅŃ¾ĶźČ«Ė®½āµÄŹŌ¼ĮŹĒ£Ø””””£©
A.µķ·Ū©µā»Æ¼ŲŹŌÖ½
B.Ņų°±ČÜŅŗ
C.µāĖ®
D.µā»Æ¼Ų
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com