
分析 (1)若A、D的水溶液均呈酸性,且D为强酸,S元素化合物符合转化关系,可推知,A为H2S、B为SO2、C为SO3、D为H2SO4;
(2)若A金属,D为强碱,则A为Na,B为Na2O,C为Na2O2,D为NaOH.
解答 解:(1)①若A、D的水溶液均呈酸性,且D为强酸,S元素化合物符合转化关系,可推知,A为H2S、B为SO2、C为SO3、D为H2SO4,故答案为:H2S;H2SO4;
②简述检验SO2物质的方法:将B通入到品红溶液中,溶液褪色,加热后,又恢复为红色,
故答案为:将B通入到品红溶液中,溶液褪色,加热后,又恢复为红色;
③硫酸的浓溶液和Cu在加热条件的化学方程式:2H2SO4(浓)+Cu$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O+SO2↑,
故答案为:2H2SO4(浓)+Cu$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O+SO2↑;
(2)若A金属,D为强碱,则A为Na,B为Na2O,C为Na2O2,D为NaOH.
①C的化学式为:Na2O2,等物质的量的Na2O和Na2O2中所含离子的物质的量之比为1:1,含有离子数目相等,
故答案为:Na2O2;相等;
②C→D的化学反应为2Na2O2+2H2O=4NaOH+O2↑,反应过氧化钠既是氧化剂又是还原剂,各占$\frac{1}{2}$,1摩尔Na2O2完全反应转移电子的物质的量为1mol×$\frac{1}{2}$×2=1mol,
故答案为:Na2O2;1mol.
点评 本题考查无机物推断,涉及Na、S等元素单质及化合物的转化,难度中等,旨在考查学生对元素化合物知识熟练掌握,注意掌握中学常见的连续反应.


科目:高中化学 来源: 题型:选择题
| A. | SO2、SO3、CO2均为酸性氧化物 | |
| B. | 稀豆浆、氯化铁溶液均为胶体 | |
| C. | 烧碱、冰醋酸、四氯化碳、氨气均为电解质 | |
| D. | 氨水、漂白粉、氢氟酸、小苏打均为纯净物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
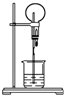 图为化学实验中常用的喷泉实验装置.在烧瓶中充满干燥气体,胶头滴管及烧杯中分别盛有液体.下列组合中不可能形成喷泉的是( )
图为化学实验中常用的喷泉实验装置.在烧瓶中充满干燥气体,胶头滴管及烧杯中分别盛有液体.下列组合中不可能形成喷泉的是( )| A. | SO2和H2O | B. | CO2和NaOH溶液 | C. | NH3和H2O | D. | NO和H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B和D、C和D组成的常见化合物中化学键的类型相同 | |
| B. | 同周期元素中D的最高价氧化物对应水化物的酸性最强 | |
| C. | 氢化物的热稳定性:HnB<HnD | |
| D. | 离子半径的大小顺序:rD>rB>rC>rA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化氢酶、酚醛树脂、尼龙、有机玻璃、PVC都是高分子化合物 | |
| B. | 分子筛、青花瓷、黏土、硅藻土的主要成分都是硅酸盐 | |
| C. | 植物秸秆发酵制沼气、玉米制乙醇、城市与工业有机废弃物的再利用都涉及生物质能 | |
| D. | 酸碱质子理论进一步扩大了人们对酸碱的认识,可以解释一些非水溶液中进行的酸碱反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCO3-的水解程度大于电离程度 | B. | HCO3-的水解程度小于电离程度 | ||
| C. | HCO3-的水解程度等于电离程度 | D. | 不能确定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com