
| A. | 蛋白质属于天然有机高分子化合物,没有蛋白质就没有生命 | |
| B. | HCHO溶液或(NH4)2SO4溶液均能使蛋白质变性 | |
| C. | 某些蛋白质跟浓硝酸作用会变黄 | |
| D. | 可以采用多次盐析或多次渗析的方法分离、提纯蛋白质 |
分析 A.蛋白质是天然有机高分子化合物,是组成人体一切细胞、组织的重要成分;
B.浓(NH4)2SO4溶液能使蛋白质溶液发生盐析;
C.蛋白质跟浓硝酸发生颜色反应;
D.蛋白质属于胶体,难溶于饱和盐溶液,不能透过半透膜.
解答 解:A.蛋白质是天然有机高分子化合物,是组成人体一切细胞、组织的重要成分,没有蛋白质就没有生命,故A正确;
B.浓(NH4)2SO4溶液能使蛋白质溶液发生盐析,HCHO溶液使蛋白质变性,故B错误;
C.蛋白质跟浓硝酸发生颜色反应,变黄色,故C正确;
D.蛋白质属于胶体,难溶于饱和盐溶液,不能透过半透膜,可用多次盐析或多次渗析的方法分离、提纯蛋白质,故D正确;
故选B.
点评 本题考查蛋白质的性质,物质的分离、提纯和鉴别,题目难度中等,注意掌握使蛋白质变性、盐析的理化条件.


 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:选择题
| A. | Na、Mg、Al原子的最外层电子数依次增多 | |
| B. | Si、P、S元素的最高正价依次升高 | |
| C. | C、N、O的原子半径依次增大 | |
| D. | Li、Na、K的金属性依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 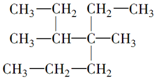 4-甲基-4,5-二乙基乙烷 4-甲基-4,5-二乙基乙烷 | B. | 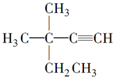 3,3-二甲基-1-戊炔 3,3-二甲基-1-戊炔 | ||
| C. | 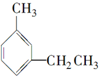 3-甲基乙基苯 3-甲基乙基苯 | D. |  3-甲基-1,3-丁二烯 3-甲基-1,3-丁二烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,OPA分子中最多有16个原子共平面.
,OPA分子中最多有16个原子共平面.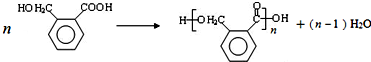 (不必注明反应条件),该反应的类型为缩聚反应.
(不必注明反应条件),该反应的类型为缩聚反应.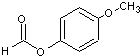 (写出其结构简式).
(写出其结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 非血红素铁是食物中铁存在的形式之一,主要是三价铁与蛋白质和羧酸结合成络合物.
非血红素铁是食物中铁存在的形式之一,主要是三价铁与蛋白质和羧酸结合成络合物.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 以Mg、Al为电极,NaOH溶液为电解质溶液的原电池中,导线上流过NA个电子,则正极放出H2的体积为11.2 L | |
| B. | 常温常压下,2.8g的乙烯和丙烯的混合气体中含碳碳双键的数目为0.1NA | |
| C. | 常温下1 L 0.5mol/L NH4Cl溶液与2L 0.25mol/L NH4Cl溶液所含NH4+的数目均为0.5NA | |
| D. | 高温下,16.8 g Fe与足量水蒸气完全反应失去0.8NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
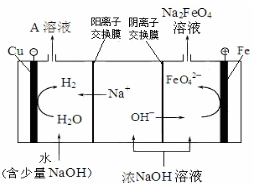
| 制备方法 | 具体内容 |
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸钾和KNO2等产物 |
| 湿法 | 强碱性介质中,Fe(NO3)3与KClO反应生成紫红色高铁酸钾溶液 |
| 电解法 | 电解浓NaOH溶液制备Na2FeO4 |
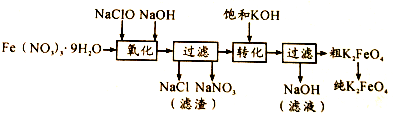
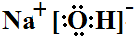 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
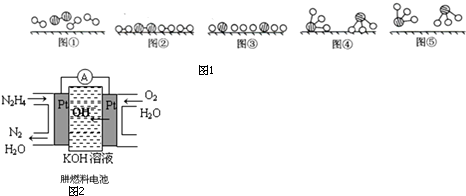
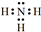 .
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com