
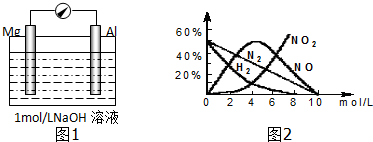
分析 (1)镁是12号元素,核外有三个电子层,最外层电子数是2,据此判断;
(2)①在碱性溶液中铝活泼,所以负极铝发生氧化反应,生成偏铝酸盐;
②铝在浓硝酸中发生钝化,所以正极上硝酸中+5价的氮发生还原反应;
(3)根据图象可知当硝酸浓度大于10.0mol/L时,气体产物只有NO2,问的是至少多少,所以就是镁反应完的时候硝酸的浓度刚好是10mol/L,剩余硝酸的物质的量为10×0.1=1mol,从而求硝酸的物质的量浓度;
(4)足量金属镁加入盐N2H6Cl2的溶液中产生H2的化学方程式为:Mg+N2H6Cl2=MgCl2+N2H4+H2↑.
解答 解;(1)镁是12号元素,核外有三个电子层,最外层电子数是2,所以镁位于周期表中第三周期第ⅡA族,
故答案为:第三周期第ⅡA族;
(2)Mg虽比Al活泼,但Mg不能与NaOH溶液反应,而Al可与NaOH溶液反应,故Al作负极,失电子生成Al3+,Al3+结合OH-生成AlO2,镁做正极,H+在镁电极上得电子生成氢气,
故答案为:Al+4OH--3e-=AlO2-+2H2O;
②铝在浓硝酸中发生钝化,所以正极上硝酸中+5价的氮发生还原反应,电极反应式为:NO3-+e-+2H+=NO2↑+H2O,故答案为:NO3-+e-+2H+=NO2↑+H2O;
(3)这个要考虑反应的产物要求是NO2,而生成NO和N2的硝酸的浓度是10mol/l,所以要求1.8gMg完全反应时,硝酸的浓度依然是不会生成NO的浓度,即大于10mol/L,问的是至少多少,所以就是镁反应完的时候硝酸的浓度刚好是10mol/L,剩余硝酸的物质的量为10×0.1=1mol.而反应过程中消耗的硝酸为X
Mg+4HNO3=Mg(NO3)2+2NO2↑+2H2O
24 4
1.8 x
$\frac{24}{1.8}=\frac{4}{x}$,解得:x=0.3mol
因此,原有硝酸的总量为:1+0.3=1.3mol
所以,硝酸的浓度为$\frac{1.3}{0.1}$=13mol/L,故答案为:13mol/L;
(4)足量金属镁加入盐N2H6Cl2的溶液中产生H2的化学方程式为:Mg+N2H6Cl2=MgCl2+N2H4+H2↑,
故答案为:Mg+N2H6Cl2=MgCl2+N2H4+H2↑或Mg+N2H6Cl2+2H2O=MgCl2+N2H4•2H2O+H2↑.
点评 本题考查了化学方程式的书写,题目难度较大,准确把握图象给出信息、熟知硝酸的性质、氧化还原反应得失电子守恒是解题关键.


 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:多选题
 北京奥运会期间对大量盆栽鲜花施用了S-诱抗素制剂,以保证鲜花盛开.S-诱抗素的分子结构如图,下列关于该物质的说法正确的是 ( )(多项选择题)
北京奥运会期间对大量盆栽鲜花施用了S-诱抗素制剂,以保证鲜花盛开.S-诱抗素的分子结构如图,下列关于该物质的说法正确的是 ( )(多项选择题)| A. | 该物质能使鲜花长期盛开 | |
| B. | 1mol该物质与NaOH溶液反应,最多消耗1mol NaOH | |
| C. | 该物质既能发生加聚反应,又能发生缩聚反应 | |
| D. | 该物质既可以与FeCl3溶液发生显色反应,又可以使酸性KMnO4溶液褪色 | |
| E. | 该物质分子式为C15H20O4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 悬挂在干燥的环境中 | B. | 经常清扫表面的灰尘可以防止生锈 | ||
| C. | 表面涂漆防止生锈 | D. | 生锈时主要生成四氧化三铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
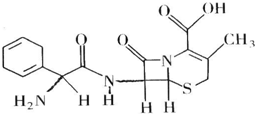 头孢拉定片(Cefradine Tablets),又称先锋,其结构式如图所示,有关该物质的描述正确的是( )
头孢拉定片(Cefradine Tablets),又称先锋,其结构式如图所示,有关该物质的描述正确的是( )| A. | 分子式为C16H20N3O4S | |
| B. | 该物质在一定条件下能发生水解 | |
| C. | 该有机物质属于芳香族化合物 | |
| D. | 该物质不能与NaHCO3溶液反应放出CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用10%的盐酸蒸发浓缩获得30%的盐酸 | |
| B. | 水晶项链和餐桌上的瓷盘都是硅酸盐制品 | |
| C. | 二氧化硫具有漂白性,与氯水混合使用效果更好 | |
| D. | 可利用丁达尔效应来区别淀粉溶液和氯化钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2+、Na+、Cl-、CO32- | B. | Ba2+、K+、OH-、NO3- | ||
| C. | H+、Al3+、NH4+、SO42- | D. | Na+、Cl-、Ca2+、HCO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com