
分析 2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O中Mn元素化合价降低,被还原,KMnO4为氧化剂,Cl元素化合价升高,被氧化,HCl为还原剂,结合化合价的变化以及电子转移数目相等的计算.
解答 解:(1)反应的离子方程式为2KMnO4+16H++10Cl-═2Mn2++5Cl2↑+8H2O,故答案为:2KMnO4+16H++10Cl-═2Mn2++5Cl2↑+8H2O;
(2)2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O中Mn元素化合价降低,被还原,KMnO4为氧化剂,Cl元素化合价升高,被氧化,HCl为还原剂,反应中Mn得到2×5e-,Cl失去10e-,电子转移数目和方向可表示为 ,
,
故答案为: ;
;
(3)n(KMnO4)=$\frac{15.8g}{158g/mol}$=0.1mol,c(KMnO4)=$\frac{0.1mol}{0.1L}$=1mol/L,
2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O
2mol 5×22.4L
0.1mol V
V=5.6L,
由方程式可知被氧化的HCl的物质的量为0.5mol,
故答案为:1mol/L;5.6L;0.5mol.
点评 本题考查氧化还原反应,侧重于学生的分析能力的考查,为高频考点,注意把握元素化合价的变化,能会用双线桥法表示电子转移的方向和数目,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 用待测液润洗滴定用的锥形瓶 | |
| B. | 常温下,某同学用pH试纸测得KCl溶液的pH约为7.0 | |
| C. | 配制Fe2(SO4)3溶液时,先把Fe2(SO4)3晶体溶于浓硫酸后稀释 | |
| D. | 用碱式滴定管准确移取KMnO4溶液,体积为21.50mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CS2为V形的极性分子 | |
| B. | ClO3- 的空间构型为平面三角形 | |
| C. | SF6中S原子和氟原子均满足最外层8电子稳定结构 | |
| D. | SiF4和SO32-的中心原子均为sp3杂化,SiF4分子呈空间正四面体,SO32-呈三角锥形 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O作配体时,Cu与H2O形成σ键 | B. | H2O的配位能力大于NH3 | ||
| C. | 乙醇可减小离子晶体的溶解度 | D. | Cu(NH3)4SO4遇BaCl2有白色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2与CH4质量比为 2:1 | B. | O2与CH4原子数之比为 1:1 | ||
| C. | O2与CH4密度比为2:1 | D. | O2与CH4分子数之比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 粒子符号 | 相对分子(原子)质量 | 每个粒子的质量(g/个) | 1mol物质含有的粒子数(个) | 1mol物质质量(g) |
| C | 1.993×10-23 | |||
| Fe | 9.302×10-23 | |||
| H2SO4 | 1.628×10-22 | |||
| H2O | 2.990×10-23 | |||
| Na+ | 3.821×10-23 | |||
| OH- | 2.824×10-23 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
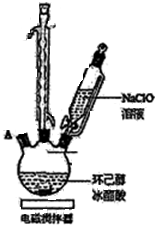 环己酮是重要化工原料,可用于制造尼龙、己二酸产品.可以尝试用次氯酸钠氧化环己醇制备环己酮:
环己酮是重要化工原料,可用于制造尼龙、己二酸产品.可以尝试用次氯酸钠氧化环己醇制备环己酮:
| 密度g/cm3 | 沸点℃ | 熔点℃ | 水溶性 | |
| 乙酸 | 1.05 | 117.9 | 16.6 | 易溶 |
| 环己醇 | 0.96 | 160.8 | 25.9 | 微溶 |
| 环己酮 | 0.95 | 155 | -4.5 | 能溶 |
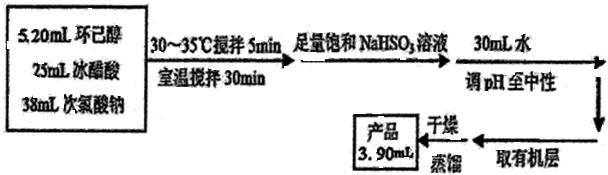
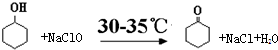 .
. ),其最可能的原因是A(填写选项编号)
),其最可能的原因是A(填写选项编号)查看答案和解析>>
科目:高中化学 来源: 题型:填空题
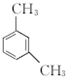 .
. 、
、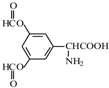 .
.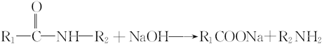
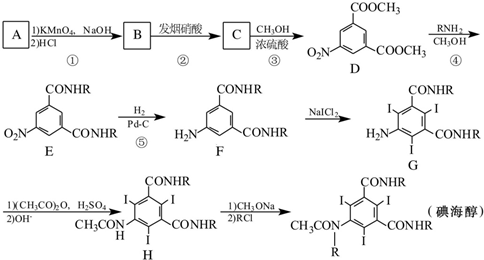
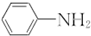 呈弱碱性,易被氧化
呈弱碱性,易被氧化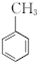 和(CH3CO)2O为原料制备染料中间体
和(CH3CO)2O为原料制备染料中间体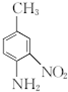 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下: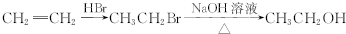
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.
(1)通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.| 化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C |
| 键能/kJ•mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com