
有A、B、C、D四块金属片,进行如下实验:①A、B用导线相连后,同时浸入稀H2SO4溶液中,A极为负极;②C、D用导线相连后,同时浸入稀H2SO4溶液中,电流由D→导线→C;③A、C相连后,同时浸入稀H2SO4溶液中,C极产生大量气泡;④B、D相连后,同时浸入稀H2SO4溶液中,D极发生氧化反应。据此,判断四种金属的活动性顺序是
A.A>B>C>D B.A>C>D>B C.C>A>B>D D.B>D>C>A
科目:高中化学 来源: 题型:
观察下列各物质间的转化图,仔细分析后回答各题。
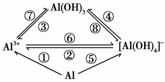
(1)图中属于氧化还原反应的有________个。
(2)若实现图中①②③④各反应的转化,可加入相同的试剂,其名称为________;试写出反应②的离子方程式:____________________________。
若实现图中⑤⑥⑧各转化反应,可加入相同的试剂,其名称为____________;氢氧化铝的用途很多,试写出实验室用反应⑦制取氢氧化铝的离子方程式:________________ ___________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应的离子方程式中正确的是( )
A. 钠与水反应:2Na+2H2O=2Na++2OH﹣+H2↑
B. 氢氧化钡溶液和硫酸铵溶液反应:Ba2++SO42﹣=BaSO4↓
C. 硫化钠溶于水呈碱性:S2﹣+2H2O⇌H2S+2OH﹣
D. 向溴化亚铁溶液中通入少量氯气:Cl2+2Br﹣=2Cl﹣+Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
将一定量的锌与100mL 18.5mol•L﹣1浓硫酸充分反应后,锌完全溶解,同时生成气体A 33.6L(标准状况).将反应后的溶液稀释至1L,则得溶液中c(H+)=0.1mol•L﹣1,则下列叙述中错误的是( )
|
| A. | 气体A为SO2和H2的混合物 | B. | 气体A中SO2和H2的体积比为1:5 |
|
| C. | 反应中消耗的Zn的质量为97.5 g | D. | 反应中共转移电子3 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关金属腐蚀与防护的说法正确的是
A.在铁门上焊接铜块能防腐蚀
B.镀锡铁制品的镀层破损后,镀层仍能对铁制品起保护作用
C.钢柱在水下部分比在空气与水交界处更容易腐蚀
D.在海轮外壳连接锌块,保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法
查看答案和解析>>
科目:高中化学 来源: 题型:
在恒容密闭容器中发生反应2NO2  2NO+O2,下列所述可以说明反应达到平衡状态的是
2NO+O2,下列所述可以说明反应达到平衡状态的是
①单位时间内生成n molO2的同时生成2n molNO2
②单位时间内生成n molO2的同时生成2n molNO
③混合气体的颜色不再改变
④混合气体的密度不再改变
A.①③ B.②④ C.①③④ D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
利用催化氧化反应将SO2转化为SO3是工业上生产
硫酸的关键步骤.
(1)T1℃时,在1L密闭容器中充入0.6molSO3,图1表示SO3
物质的量随时间的变化曲线。
①平衡时,SO3的转化率为 (保留小数点后一位) ;
T1℃时,反应2SO2(g)+O2(g)  2SO3(g) 的平衡常数为 ;其他条件不变,在8min时压缩容器体积至0.5L,则n(SO3
2SO3(g) 的平衡常数为 ;其他条件不变,在8min时压缩容器体积至0.5L,则n(SO3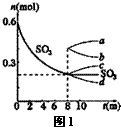 )的变化曲线为 (填字母)。
)的变化曲线为 (填字母)。
②下表为不同温度(T)下,反应2SO2(g)+O2(g)  2SO3(g) (△H<0)的化学平衡常数(K)
2SO3(g) (△H<0)的化学平衡常数(K)
| T/℃ | T2 | T3 |
| K | 20.5 | 4.68 |
由此推知,温度最低的是 (填“T1”、“T2” 或 “T3”)。
③在温度为T1℃时,向该1L的密闭容器中同时加入0.2molSO2、xmolO2、0.2molSO3三种气体,在达到平衡前若要使SO3的浓度减小,则x的取值范围是 。
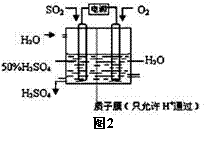
(2)科学家研究出用电化学原理生产硫酸的新工艺,装置如图2所示,总反应的化学方程式为 ,其阳极的电极反应式为
 |
查看答案和解析>>
科目:高中化学 来源: 题型:
SO2、NO是大气污染物。吸收SO2 和NO,获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素):
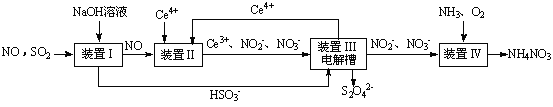
(1)装置Ⅰ中生成HSO3-的离子方程为 。
(2)含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数X(i)与溶液pH 的关系如右图所示。
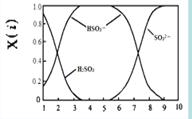
①下列说法正确的是 (填字母序号)。
a.pH=8时,溶液中c(HSO3-) < c(SO32-)
b.pH=7时,溶液中c(Na+) =c(HSO3-)+c(SO32-)
c.为获得尽可能纯的NaHSO3,可将溶液的pH控制在4~5左右
②向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因: 。
(3)装置Ⅱ中,酸性条件下,NO被Ce4+氧化的产物主要是NO3-、NO2-,写出生成NO3-的离子方程式 。
(4)装置Ⅲ的作用之一是再生Ce4+,其原理如下图所示。
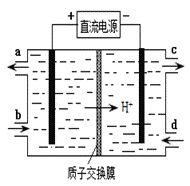
①生成Ce4+的电极反应式为 。
②生成Ce4+从电解槽的 (填字母序号)口流出。
(5)已知进入装置Ⅳ的溶液中,NO2-的浓度为a g·L-1,要使1 m3该溶液中的NO2-完全转化为NH4NO3,需至少向装置Ⅳ中通入标准状况下的O2 L。(用含a代数式表示,计算结果保留整数)
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上用甲苯生产对羟基苯甲酸乙酯(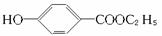 ),其过程如下:
),其过程如下:

据合成路线填写下列空白:
(1)有机物A的结构简式:____________________,B的结构简式:____________________。
(2)反应④属于____________反应,反应⑤属于______________反应。
(3)③和⑥的目的是______________________________________________。
(4)写出反应⑥的化学方程式:__________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com