
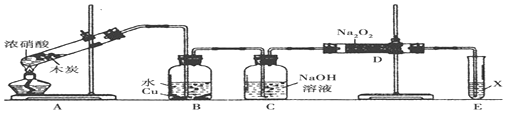
分析 以木炭和浓硝酸为起始原料,探究一氧化氮与过氧化钠反应制备亚硝酸钠,由图可知,组装好仪器后,先检查装置的气密性,A中发生C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O,B中二氧化氮与水反应生成硝酸,然后Cu与硝酸反应生成NO,C中利用NaOH溶液吸收二氧化碳,在D中NO与过氧化钠反应生成亚硝酸钠,可能还发生水与过氧化钠的反应生成NaOH,结合信息在酸性溶液中,NO2-可将MnO4-还原为Mn2+且无气体生成,可知X吸收亚硝酸,以此来解答.
(1)组装好仪器后,必须进行的一项操作是检查装置的气密性;
(2)碳单质和浓硝酸加热反应生成二氧化氮、二氧化碳和水;
(3)酸性溶液中,NO2-可将MnO4-还原为Mn2+且无气体生成,检验亚硝酸钠,可以将其在酸性溶液中溶解产生一氧化氮,一氧化氮和氧气反应生成二氧化氮,也可以将其与酸性高锰酸钾溶液反应;
(4)气体经过溶液会带出水蒸气,水和过氧化钠反应会产生氢氧化钠,用装有碱石灰的干燥管代替C装置可除水;
(5)n(Na2O2)=$\frac{1.56g}{78g/mol}$=0.02mol,根据2NO+Na2O2=2NaNO2、3NO2+H2O=2HNO3+NO、C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O计算需要C的质量.
解答 解:(1)该实验目的为:以木炭和浓硝酸为起始原料,探究一氧化氮与过氧化钠反应制备亚硝酸钠,因有气体参与反应且反应中需制备气体,所以组装好仪器后,必须进行的一项操作是检查装置的气密性,
故答案为:检查装置的气密性;
(2)装置A的试管中碳和浓硝酸反应,发生反应的化学方程式为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O,
故答案为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O;
(3)根据所给信息可知,若检验亚硝酸钠,可以将其在酸性溶液中溶解产生一氧化氮,一氧化氮和氧气反应生成二氧化氮,也可以将其与酸性高锰酸钾溶液反应,则方法为将生成物置于试管中,加入稀硫酸,若产生无色气体并在液面上方变为红棕色,则D中产物是亚硝酸钠(或将生成物置于试管中,加入酸性KMnO4溶液,若溶液紫色褪去,则D中产物是亚硝酸钠),
故答案为:将生成物置于试管中,加入稀硫酸,若产生无色气体并在液面上方变为红棕色,则D中产物是亚硝酸钠(或将生成物置于试管中,加入酸性KMnO4溶液,若溶液紫色褪去,则D中产物是亚硝酸钠);
(4)由于NO通过氢氧化钠溶液进入D装置时会带入水蒸气,根据原子守恒可知,生成的固体物质应该还有NaOH;若要避免生成NaOH,应该除去水蒸气,则改进方法为用装有碱石灰的干燥管代替C装置,
故答案为:NaOH;用装有碱石灰的干燥管代替C装置;
(5)n(Na2O2)=$\frac{1.56g}{78g/mol}$=0.02mol,根据2NO+Na2O2=2NaNO2知,0.02mol过氧化钠反应需要0.04molNO,根据3NO2+H2O=2HNO3+NO知生成0.04molNO需要0.12mol二氧化氮、根据C+4HNO3(浓) $\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O知生成0.12mol二氧化氮需要0.03molC,则C的质量=12g/mol×0.03mol=0.36g,
故答案为:0.36.
点评 本题考查性质实验方案的评价及实验装置的综合应用,为高频考点,把握装置的作用、气体的制备实验等为解答的关键,侧重分析与实验能力的考查,注意碳、氮族元素化合物知识的综合应用,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | FeS+稀H2SO4 | B. | NaOH+FeCl3 | C. | Cl2+NaOH溶液 | D. | SO2+NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤ | B. | ②③④⑤ | C. | ①③④⑤ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将某溶液与稀盐酸反应产生的气体通入澄清石灰水 | 石灰水变浑浊 | 该溶液中一定含有CO32- |
| B | 将干燥的Cl2通过有色鲜花 | 鲜花褪色 | Cl2有漂白性 |
| C | 向某无色溶液中滴加氯水和CCl4,振荡、静置 | 下层溶液显紫色 | 原溶液中有I- |
| D | 取久置的Na2O2粉末,向其中滴加过量的盐酸 | 产生气体 | Na2O2没有变质 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蔗糖与浓硫酸混合产生刺激性气味的气体 C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O | |
| B. | 向硫酸铵溶液中加入氢氧化钡溶液:Ba2++SO42-═BaSO4↓ | |
| C. | Cu溶于稀硝酸HNO3:Cu+2H++NO3-═Cu2++NO2↑+H2O | |
| D. | 向溴化亚铁溶液中通入过量氯气:2Fe2++2Br-+2Cl2═2Fe3++4Cl-+Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 萃取时将萃取剂直接注入漏斗中 | |
| B. | 萃取操作完成后,静置分层,上下层液体依次从下口放出 | |
| C. | 用一种有机溶剂,提取水溶液中的某物质,静置分层,“水层”必须在上层 | |
| D. | 萃取时所选溶剂应与原溶剂互不相溶,且与溶质不反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用锌和稀硫酸制备H2 | B. | 用铜和稀硝酸制备NO | ||
| C. | 用30%H2O2水溶液和MnO2制备O2 | D. | 用MnO2和浓盐酸制备Cl2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com