
| A. | 食盐可做食物调味剂,也可做食品防腐剂 | |
| B. | 高锰酸钾溶液、酒精、双氧水都能杀菌消毒,都利用了强氧化性 | |
| C. | 海水淡化的方法主要有蒸馏法、离子交换法等 | |
| D. | 通常所说的三大合成材料是指塑料、合成橡胶和合成纤维 |
分析 A.NaCl具有咸味,食盐腌制食品,以抑制细菌的滋生,常用作调味品和防腐剂;
B.酒精不具有强氧化性;
C.海水淡化降低盐的浓度;
D.塑料、合成橡胶和合成纤维均为有机合成高分子.
解答 解:A.食盐腌制食品,食盐进入食品内液产生浓度差,形成细菌不易生长的环境,可作防腐剂,食盐具有咸味,所以食盐可作调味剂,也可作食品防腐剂,故A正确;
B.酒精不具有强氧化性,可使蛋白质发生变性,用于消毒,故B错误;
C.海水淡化降低盐的浓度,淡化的方法主要有蒸馏法、离子交换法等,故C正确;
D.塑料、合成橡胶和合成纤维均为有机合成高分子,则通常所说的三大合成材料是指塑料、合成橡胶和合成纤维,故D正确;
故选B.
点评 本题考查物质的性质及应用,为高频考点,把握物质的性质、发生的反应、性质与用途的关系为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 氧原子的原子结构示意图: | |
| B. | 羟基的结构式:O-H | |
| C. | 用电子式表示Na2O的形成过程: | |
| D. | 组成为C2H6O的分子中可能只存在极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,l.6g${\;}_{6}^{14}$CH4中含有共价键总数为0.4NA | |
| B. | 密闭容器中2molNO与1molO2充分反应后,容器内气体的分子数为2NA | |
| C. | 1 L 0.lmol•L-1的CH3COONa溶液中CH3COO-和CH3COOH粒子数之和为0.1NA | |
| D. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
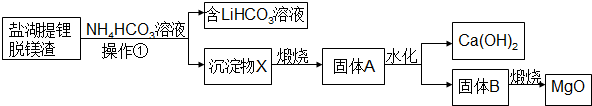
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
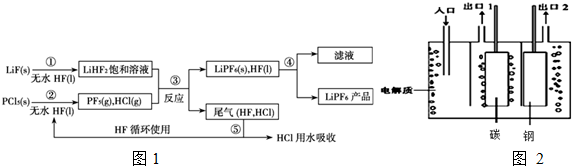
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2=CH-CH=CH2 1,3-二丁烯 | |
| B. | CH3COOCH2CH2OOCCH3 乙二酸二乙酯 | |
| C. | CH3CH2CH(OH)CH3 3-丁醇 | |
| D. | 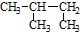 2-甲基丁烷 2-甲基丁烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 获得新核素${\;}_{113}^{278}$Ja的过程,是一个化学变化 | |
| B. | 题中涉及的三种元素,都属于金属元素 | |
| C. | 这种超重核素${\;}_{113}^{278}$Ja的中子数与质子数只差为52 | |
| D. | 这种新核素,是同主族元素中原子半径最大的 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com