
| A. | a=4 | B. | 还原剂是Fe2+ | ||
| C. | 氧化剂是O2 | D. | Y的化学式为Fe3O4 |
分析 3Fe2++2S2O32-+O2+aOH-═Y+S4O62-+2H2O中,4个S原子中S的化合价由+2升高为+2.5,O元素的化合价由0降低为-2,利用质量守恒及电子守恒和氧化还原反应的有关概念来分析.
解答 解:A.Y为化合物,根据电荷守恒可知,6-4-a=4,故a=4,故A正确;
B.因S2O32-中S元素的化合价升高,由+2升高为+2.5,则S2O32-是还原剂,故B错误;
C.O元素的化合价由0降低为-2,则氧化剂是O2,故C正确;
D.Y为化合物,根据质量守恒可知,则Y为Fe3O4,故D正确;
故选D.
点评 本题考查氧化还原反应,元素的化合价判断是解答本题的关键,注意S元素的化合价是解答的难点,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
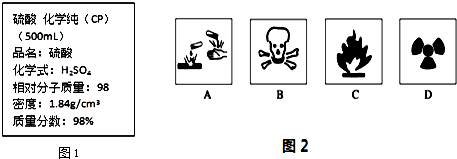
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 80% | B. | 20% | C. | 40% | D. | 60% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑤ | B. | ②④ | C. | ①②⑤ | D. | 全部正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤(不要求写出具体操作过程) | 预期实验现象和结论 |
| 取少量黑色固体加入足量稀盐酸(或稀硫酸)溶解, 在溶液中滴加KSCN溶液 | 若溶液不变红色,则假设一成立. 若溶液变红色,则假设一不成立 |
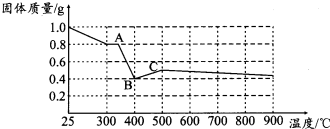
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳元素既被氧化又被还原 | |
| B. | 氧化剂与还原剂的物质的量之比为1:2 | |
| C. | 每生成3molNa2S2O3,转移8mol电子 | |
| D. | 相同条件下,每吸收10m3SO2就会放出10m3CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ②③④⑤ | C. | ③⑥⑦ | D. | ②⑤⑥⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
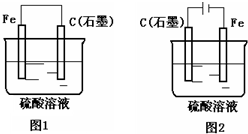
| A. | 两装置中,铁电极均要消耗 | |
| B. | 图2装置中两极均有气泡产生 | |
| C. | 图1装置铁电极上发生的电极反应为:Fe-3e-═Fe3+ | |
| D. | 随着反应的进行,图1装置中溶液的pH增大,图2装置中溶液的pH不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com