
| |||||||||||||||||||||||
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源:黄冈重点作业 高三化学(下) 题型:058
| |||||||||||||||||||||||
查看答案和解析>>
科目:高中化学 来源: 题型:

试完成下列问题:
(1)⑥中反应的化学方程式为_____________。
(2)①中的实验现象为_____________,此实验证明SO2是_____________气体。
(3)②中的品红溶液_____________,证明SO2有_____________性。
(4)③中的实验现象是_____________,证明SO2有_____________性。
(5)④中的实验现象是_____________,证明SO2有_____________性。
(6)⑤的作用是_____________,反应的化学方程式是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示为实验室制SO2并验证SO2的某些性质的装置图。
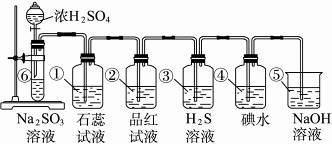
试完成下列问题:
(1)⑥中反应的化学方程式为_____________。
(2)①中的实验现象为_____________,此实验证明SO2是_____________气体。
(3)②中的品红溶液_____________,证明SO2有_____________性。
(4)③中的实验现象是_____________,证明SO2有_____________性。
(5)④中的实验现象是_____________,证明SO2有_____________性。
(6)⑤的作用是_____________,反应的化学方程式是__________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com